选项 | 实验 | 操作 |
A | 检验Fe(NO3)2晶体是否变质 | 将样品溶于稀硫酸,滴入几滴KSCN溶液 |
B | 验证Mg(OH)2 和Fe(OH)3的Ksp大小 | 取2mL 1.0mol/L NaOH 溶液,先滴3 滴1.0mol /L MgCl2溶液,再滴3 滴1.0mol/L FeCl3溶液 |
C | 比较醋酸和碳酸酸性强弱 | pH 计分别伸入0.1mol/L CH3COONa 溶液和0.1mol/LNa2CO3溶液中,读取pH |
D | 测定中和反应反应热 | 混合前分别用冲洗干净的温度计测量50mL0.50mol/L HCl溶液与50mL 0.55mol/L NaOH 溶液的温度 |
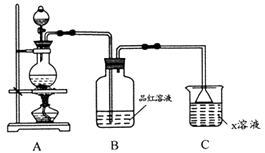
①装置连接顺序:x→;
②能证明上述假设成立的实验现象是。
![]()
写出产生该灰白色悬浮物主要反应的化学方程式。
a.CH4(g)+H2O(g) CO(g)+3H2(g) △H=+216.4kJ/mol
b.CO(g)+H2O(g) CO2(g)+H2(g) △H=-41.2kJ/mol
则反应CH4(g)+2H2O(g) CO2(g)+4H2(g) △H=。

①恒压时,反应一定达到平衡状态的标志是(填序号);
A.N2和H2的转化率相等
B.反应体系密度保持不变
C. 比值保持不变
D. =2
②P1P2 (填“>”、“<”、“=”、“不确定”,下同);反应平衡常数:B点D点;
③C点H2的转化率;在A、B两点条件下,该反应从开始到平衡时生成氨气平均速率:v(A) v(B)。
①写出NH3和NaClO 反应生成N2H4的化学方程式;
②已知25℃时N2H4水溶液呈弱碱性:N2H4+H2O N2H5++OH- K1=1×10-a;N2H5++H2O
N2H62++OH- K2=1×10-b。
25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+)>c(N2H4),同时c(N2H5+)>c(N2H62+),应控制溶液pH范围(用含a、b式子表示)。

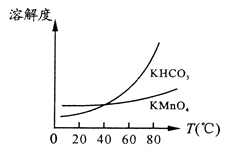
由下图可知,从滤液Ⅲ得到KMnO4需经过、、洗涤等操作。
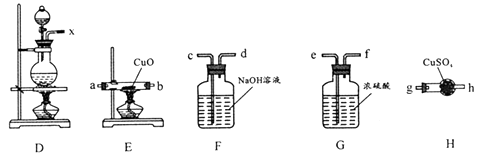
①电解槽阳极反应式为;
②阳极还可能有气体产生,该气体是。
①[Cu(NH3)4]SO4中化学键类型有,[Cu(NH3)4]2+ 的结构简式为,阴离子中心原子杂化类型为。
②氨的沸点远高于膦(PH3),原因是。
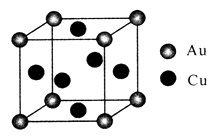
①该合金的化学式为;
②已知该合金的密度为dg/cm3 , 阿伏加德罗常数值为NA , 两个金原子间最小间隙为apm(1pm=10-10cm)。则铜原子的半径为cm(写出计算表达式)。