 量取浓硫酸
B .
量取浓硫酸
B .  稀释浓硫酸
C .
稀释浓硫酸
C .  转移入容量瓶
D .
转移入容量瓶
D .  定容
定容
①浓硫酸的吸水性:各取0.5g胆矾颗粒于试管中,分别加入3mL不同浓度的硫酸。
②浓硫酸的脱水性:各取一根木柴梗于试臂中,分别加入1mL不同浓度的硫酸。
③浓硫酸的钝化:各取约1cm经过砂纸打磨过的铁丝,再向试管中加入3mL不同浓度的硫酸。
实验结果见下表:
实验 | c(H2SO4)/mol/L | 18.4 | 12 | 11 | 10 | 9 | 8 | 7 | 6 | 1-5 |
① | 胆矾颜色变化 | 蓝一白 | 蓝一白 | 蓝一白 | 蓝 | 蓝 | 蓝 | 蓝 | 蓝 | 蓝 |
② | 木柴梗颜色变化 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 变黑 | 不变 |
③ | 铁丝表面气泡 | 无 | 无 | 有 | 有 | 有 | 有 | 有 | 有 | 有 |
结合表格数据回答下列问题:
用化学方程式表示胆矾由“蓝一白”的原因:;当硫酸的浓度≥mol/L时即具有脱水性。
在试管中分别加入1小块铜片,再向试管中分别加入2mL 不同浓度的硫酸,用下图所示的装置进行实验。(夹持仪器略去)

①b装置的作用是
②本实验中证明浓硫酸具有强氧化性的现象是、。
③试管a中加热时产生黑色的固体,经检验该黑色固体中含有Cu2S。写出生成该物质的化学方程式.
④经过实验发现:c(H2SO4)≥ 6mol/L时,硫酸与铜在加热反应时即可表现强氧化性。有同学预测,铜片与5mol/L的硫酸在长时间持续加热时,也会发生反应。该预测的理由是.
已知①CO(g)+H2O(g) CO2(g)+H2(g) ΔH1=-41.0 kJ/mol
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=-49.0 kJ/mol
③CH3OCH3(g)+H2O(g) 2CH3OH(g) ΔH3=+23.5 kJ/mol
则反应2CO(g)+4H2(g) CH3OCH3(g)+H2O(g)的△H=.
①973 K时,测得:
NO2(g) NO(g)+ 1/2O2(g) K1=0.018;
SO2(g)+1/2O2(g) SO3(g) K2=20;
则反应SO2(g)+NO2(g) SO3(g)+NO(g)的K3=
②973K时,向容积为2 L的密闭容器中充人SO2、NO2 各0.2mol。平衡时SO2的转化率为。
③恒压下,SO2的分压PSO2随温度的变化如图所示:

当温度升高时,SO2(g)+NO2(g) SO3(g)+NO(g)的化学平衡常数(填“增大”或“减小”), 判断理由 是.
①纳米铁粉与水中NO3-反应的离子方程式为4Fe+NO3-+10H+=4Fe2++NH4++3H2O。研究发现,若PH偏低将会导致NO3-的去除率下降,其原因是.
②相同条件下,纳米铁粉去除不同水样中的NO3-的速率有较大差异。
下表中Ⅰ和Ⅱ产生差异的原因可能是;Ⅱ中0~20min,用NO3-表示的平均反应速率为mol·L-1·min-1。
反应时间/min | 0 | 10 | 20 | 30 | 40 | |
Ⅰ | c(NO3-)/10-4 mol/L | 8 | 3.2 | 1.6 | 0.8 | 0.64 |
Ⅱ | c(NO3-)/10-4 mol/L (含少量Cu2+) | 8 | 0.48 | 0.32 | 0.32 | 0.32 |
A.[Na+]+[H+]=[HSO3-]+2[SO32-]+[OH-]
B.[Na+]=[HSO3-]+[SO32-]+[H2SO3]
C.[Na+]>[SO32-]>[HSO3-]>[OH-]>[H+]
D.[H+]+[SO32-]=[OH-]+[H2SO3]
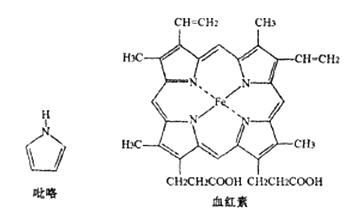
①已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为
②1mol吡咯分子中所含的σ键总数为个。分子中的大π键可用中表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡略环中的大π键应表示为。
③C、N、O三种元素的简单氢化物中,沸点由低到高的顺序为(填化学式)。
④血液中的O2是由血红素在人体内形成的血红蛋白来输送的,则血红蛋白中的Fe2+与O2是通过键相结合。
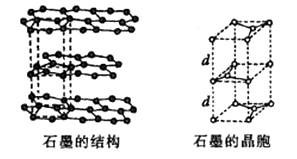

已知:Ⅰ 
Ⅱ ![]()
回答下列问题: