I:将红热的铁丝伸入盛满氯气的集气瓶,观察铁丝在氯气中燃烧,有大量棕黄色烟。该反应的化学方程式是。
II:在空气中点燃H2 , 然后将导管缓缓伸入盛满氯气的集气瓶,可观察到H2在氯气中安静燃烧,产生色的火焰,瓶口有白雾的现象。
由实验I、II可知,上述推测(填“正确”或“不正确”);理由是。
III:将氯气溶于水,制得氯水。下列物质不能与新制氯水反应的是。
Na2CO3溶液 B.FeCl2溶液 C.AgNO3 溶液 D.CuCl2溶液
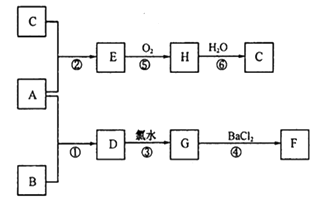
则:①A和B 分别为:A B;
②A与B发生反应的条件是;
③反应⑥的化学方程式为;
④上述反应中,不属于氧化还原反应的是。(填数字序号)。
①无论采用何种试剂进行配制,实验必须用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,至少还需要的一种仪器是,在使用该仪器前必须进行的操作是。
②若用胆矾晶体进行配制,需要托盘天平称取CuSO4•5H2O的质量为g。
③用4 mol/L 的CuSO4溶液配制溶液所需的实验步骤如下,其正确的操作顺序为。
a.往烧杯中加入约100 mL水进行初步稀释,冷却至室温
b.用量筒量取一定体积4mol/L 的CuSO4溶液于一烧杯中
c.计算所需4 mol/L 的CuSO4溶液的体积
d.盖好瓶塞,反复上下颠倒摇匀后,将溶液转存于试剂瓶中
e.加水至液面离容量瓶刻度线1~2cm处,改用胶头滴管进行定容
f.洗涤烧杯和玻璃棒2~3次并将洗涤液注入容量瓶,轻摇容量瓶,使溶液混合均匀
g.将溶液转移入容量瓶
④下列操作将使所配溶液物质的量浓度偏高的是。
A.d步骤摇匀后发现液面低于刻度线,再加蒸馏水至刻度线
B.移液时不小心溅出少许溶液
C.容量瓶查漏后未经干燥就直接使用
D.e步骤中,俯视刻度线
E.未洗涤烧杯和玻璃棒