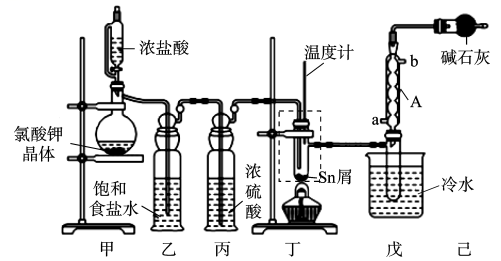
已知:①SnCl4熔点为-33 ℃,沸点为114.1 ℃,在潮湿空气中极易水解(水解生成SnO2·xH2O),且熔融Sn与Cl2反应生成SnCl4时放出大量的热。
②Sn熔点为232℃,沸点为2260℃;无水SnCl2熔点为246℃,沸点为652℃,Sn2+易被Fe2+、I2等氧化为Sn2+。
①甲同学:准确称取a g产品于锥形瓶中,用蒸馏水溶解,用n mol/L 酸性高锰酸钾标准溶液滴定,滴定终点时消耗酸性高锰酸钾标准溶液xmL。由此可以计算产品中Sn2+的质量分数。乙同学认为甲同学的方案明显不合理,会导致测得的Sn2+的质量分数严重偏高,理由是。
②乙同学:用碘氧化法滴定分析产品中Sn2+的含量。准确称取a g产品于锥形瓶中,用蒸馏水溶解,淀粉溶液做指示剂,用b mol/L 碘标准溶液滴定,发生反应Sn2++I2=Sn4++2I-。滴定终点消耗碘标准溶液V mL,产品中Sn2+的质量分数为(用含a、b、V的代数式表示)。


相关金属离子[c0(Mn+)=0.1 mol/L]开始形成氢氧化物沉淀的pH如下(当c(M+)≤10-5mol/L,可以认为Mn+沉淀完全):
金属离子 | Ca2+ | Zn2+ | Ni2+ | Fe3+ |
开始沉淀时的pH | 10.6 | 7.6 | 7.1 | 1.5 |
回答下列问题:

①含有苯环且苯环上只有两个取代基②能与NaHCO3溶液反应放出CO2
其中核磁共振氢谱显示为5组峰,且峰面积之比为3:2:2:2:1的同分异构体的结构简式为(任意写一种)。