| 相关反应 | 平衡常数( | |
ⅰ | |||
ⅱ | |||
ⅲ |
请回答下列问题:
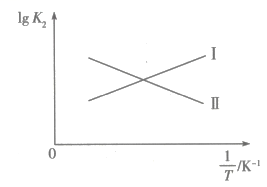
①温度 , 理由是。
②在温度下,该反应的平衡常数
(用分数表示,
是用平衡分压代替平衡浓度计算的平衡常数,分压=总压×物质的量分数)。
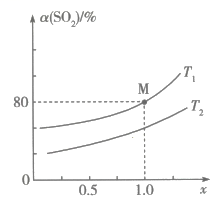
③其他条件不变,若向M点反应体系中充入一定量的(
不参与反应),则
的平衡转化率(填“增大”“减小”或“不变”),原因是。
①配制溶液过程中用托盘天平称量固体的质量为g。
②定容时,加蒸馏水不慎超过刻度线,处理的方法是。
装置 | 实验 | 试剂a | 现象 |
| 甲 | 4mL | 产生白色沉淀 |
乙 | 4mL | 产生白色沉淀及大量气体 | |
丙 | 4mL | 产生白色沉淀及大量气体 |
为了探究白色沉淀的成分,设计了热分解实验,其装置如图所示:
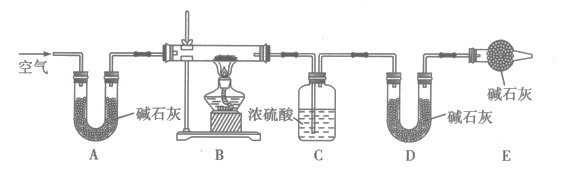
将实验乙、丙所得沉淀分别置于装置B中使样品完全分解,实验结束后,数据记录如下:
样品 | 加热前样品质量/g | 加热后样品质量/g | 装置C增重/g | 装置D增重/g |
实验乙样品 | 10.4 | 6.8 | 3.6 | 0 |
实验丙样品 | 22.4 | 16.2 | 1.8 | 4.4 |
①实验甲产生白色沉淀反应的离子方程式为。
②装置E的作用是。
③通过热分解实验可判断实验乙所得白色沉淀的成分为(填化学式),实验乙反应的离子方程式为。
④实验丙所得白色沉淀的化学式可表示为 , 则
。
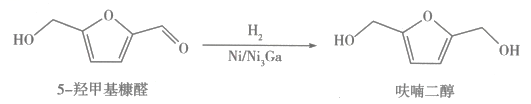
①常用银氨溶液检验5-羟甲基糠醛和呋喃二醇。制备银氨溶液的操作如下:向盛有溶液的洁净试管中滴加
稀氨水至浊液刚好变澄清,得到的溶液为银氨溶液,主要成分是
。相对于
的稀氨水,所得到的银氨溶液的pH(填“升高”“降低”或“不变”),其原因是。
②呋喃二醇的沸点高于5-羟甲基糠醛,其主要原因是。
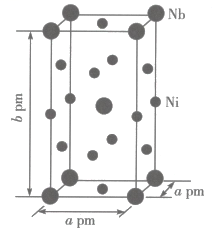
设表示阿伏加德罗常数的值,该晶体的密度为
(列出计算式)。