①CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1=-49.4kJ•mol-1
②CO2(g)+H2(g)CO(g)+H2O(g) △H2=+41.2kJ•mol-1
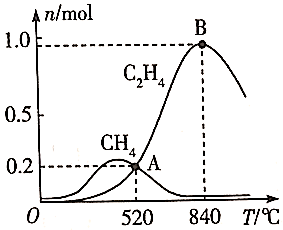
其他条件不变,在相同时间内温度对CO2催化加氢的影响如图。下列说法不正确的是( )

已知:CH3OH的选择性=×100%
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
①反应Ⅳ:
。
②在某种催化剂的作用下,在容积为2.0L的恒容密闭容器中充入和
, 体系中主要发生上述反应Ⅰ和反应Ⅳ两个竞争反应。反应进行
时测得两种烃的物质的量随温度的变化如下图所示,该催化剂在840℃时主要选择(填“反应Ⅰ”或“反应Ⅳ”);520℃时,
内用氢气表示反应Ⅳ的平均反应速率
(用含t的代数式表示)。
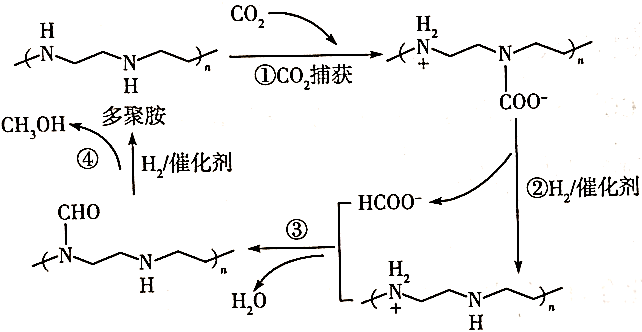
该反应机理中,多聚胺的作用是,该反应机理的总反应的化学方程式是。
①上述反应达到平衡时,其他条件不变,向恒压密闭容器中充入少量 , 甲醇的平衡转化率(填“增大”“减小”或“不变”)。
②温度为TK,按投料比向恒容密闭容器中投料,平衡前后气体的压强之比为6:5,测得平衡体系中气体的压强为
, 则TK时该反应的压强平衡常数
(以分压表示,分压=总压×物质的量分数)。
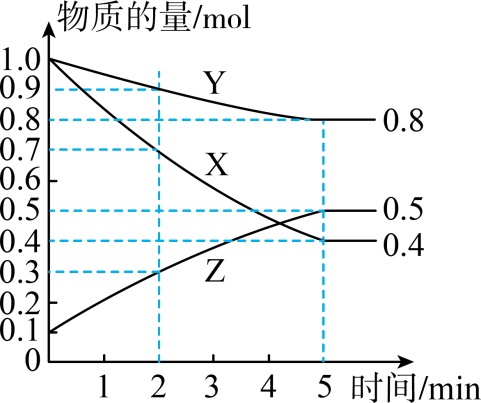
①该反应的化学方程式是。
②4min时,υ正υ逆(填“>”“<”或“=")。
③若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经相同时间后,测得三个容器中的反应速率分别为甲:υ(X)=0.3mol·L-1·s-1 , 乙:υ(Y)=0.12mol·L-1·s-1 , 丙:υ(Z)=9.6mol·L-1·min-1.则甲、乙、丙三个容器中反应速率由快到慢的顺序为。
④下列措施能增大该反应速率的是(选填字母)
A.升高温度 B.恒容条件下充入Ar气
C.减小Z的浓度 D.将反应容器体积缩小
a.2υ逆(NO)=υ正(O2)
b.容器内压强保持不变
c.υ(NO2)=2υ(O2)
d.容器内的密度保持不变
e.容器内混合气体平均相对分子质量不变
f.c(NO):c(O2):c(NO2)=2:1:2
g.容器内气体颜色不变
实验序号 | NaOH溶液体积/mL | 待测HA溶液体积/mL |
1 | 21.01 | 20.00 |
2 | 20.99 | 20.00 |
3 | 21.60 | 20.00 |
化学式 | 电离平衡常数( |
| |
|
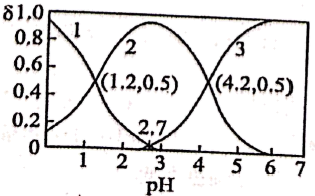
①等浓度的、
、
结合的
能力由强到弱的顺序为:.
②将过量气体通入
溶液中的离子反应方程式为:.
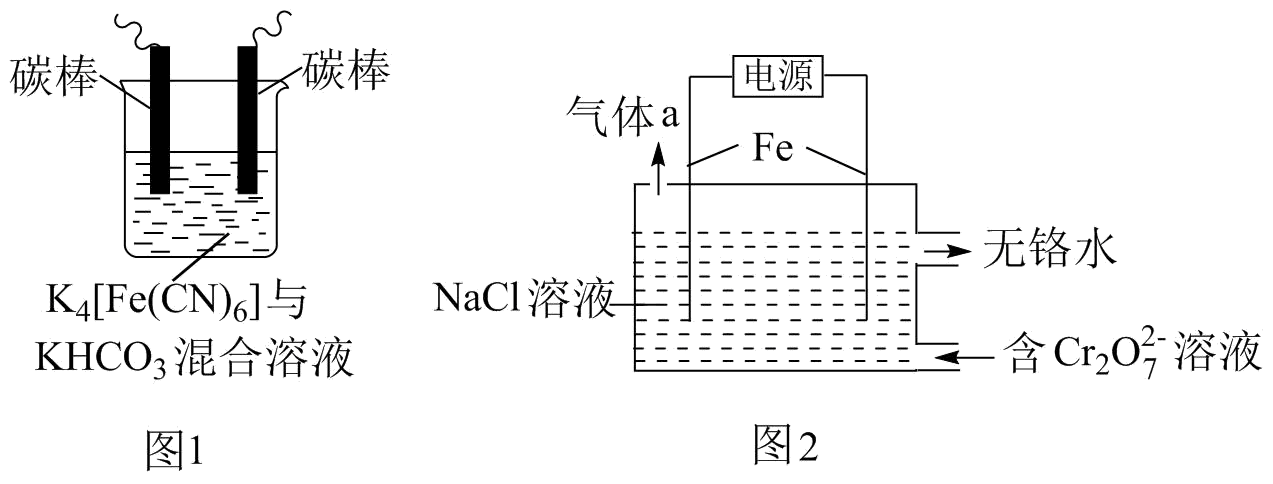
已知:+ H2O=2
+2H+
氧化性:>
①电解过程中主要反应之一:+6Fe2++17H2O= 2Cr(OH)3↓+6Fe(OH)3↓+10H+;气体a主要成分是。
②电解过程中,不同pH时,通电时间与Cr元素的去除率关系如图3所示,pH=10相比pH=4,Cr元素的去除率偏低的原因可能是。
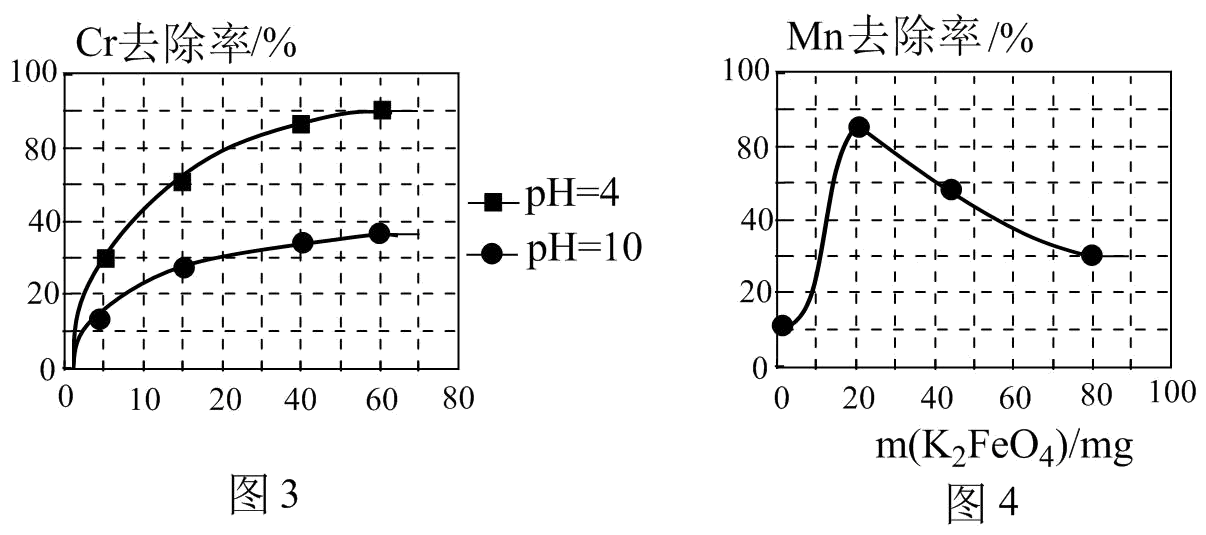
已知:K2FeO4具有强氧化性,极易溶于水
①在酸性条件下,能与废水中的Mn2+反应生成Fe(OH)3和MnO2沉淀来除锰,该反应的离子方程式。
②用K2FeO4处理1L 50 mg/L的含Mn2+废水,Mn元素的去除率与K2FeO4量的关系如图4所示,当K2FeO4超过20 mg时,Mn元素的去除率下降的原因可能是。