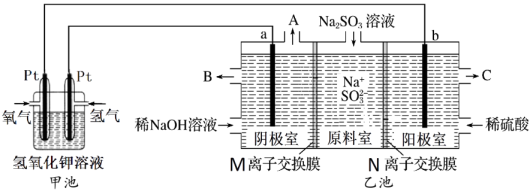
②阴极室中溶液浓度增大的原因是:阴极室中水电离出的(用离子符号或化学式填空,下同)得电子反应生成,其浓度减小,使溶液中浓度增大,为了保持阴极室溶液中阴阳离子电荷平衡,从原料室向阴极室迁移,从而使阴极室中
的浓度增大。
已知:常温下,反应(白色)和
(红色)的平衡常数分别为
、
。
常温下,将溶液和
溶液等体积混合,产生灰黑色沉淀,溶液呈黄色,过滤得澄清滤液X。
用溶液滴定测定滤液
中
浓度。
①量取滤液X。用(填“酸式”或“碱式”)滴定管取一定体积滤液X于锥形瓶中,若滴定管未用滤液润洗,对
浓度测定结果是(填“偏高”、“偏低”或“无影响”)。
②用溶液滴定滤液中
。滴定终点的现象为:当最后半滴
溶液滴入后,,此时为滴定终点。重复三次实验,实验数据如下表所示。根据表中数据计算出的滤液
中
的平均浓度是
(用含
的计算式表示)。
实验编号 | 滤液 | 滴定前 | 滴定后 |
1 | 10.00 | 3.10 | 23.06 |
2 | 10.00 | 0.50 | 20.50 |
3 | 10.00 | 2.36 | 22.40 |
常温下,用溶液和
溶液,按下表配制总体积相同的系列溶液,测定平衡时
浓度,记录数据。
实验编号 | ||||
ⅰ | 10 | 10 | 0 | |
ⅱ | 4 |
①,
。
②和
存在的关系是(用含
和
的不等式表示),该关系可以作为判断稀释对该反应平衡移动方向影响的证据。
反应Ⅰ:
反应Ⅱ:
①该条件下,与
反应生成
的热化学方程式为.
②一定条件下的密闭容器中发生反应Ⅰ,平衡时混合物中的物质的量分数在不同温度(
、
、
)随压强的变化如图所示。
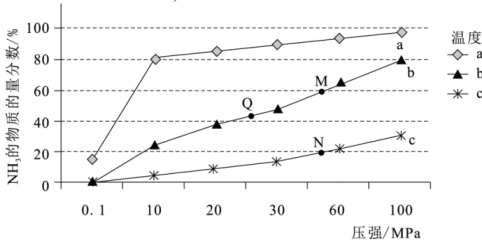
则曲线对应的温度是,
点平衡常数
的大小关系是。
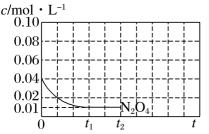
①下列各项中能说明该反应已达到化学平衡状态的是。
A.容器内压强不变 B.
C.混合气体的颜色不变 D.混合气体的密度不变
②时刻反应达到平衡,若
, 计算
内的平均反应速率
,此时
的转化率为。
③反应温度时,画出
时段,
随
变化曲线。保持其他条件不变,改变反应温度为
, 再次画出
时段,
随
变化趋势的曲线。(在答题卡方框中完成)