 B .
B .  C .
C . 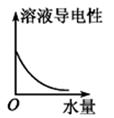 D .
D . 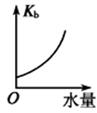

①CO(g)+2H2(g)CH3OH(g) ΔH1<0 K1
②2CH3OH(g)CH3OCH3(g)+H2O(g) ΔH2<0 K2
③CO(g)+H2O(g)CO2(g)+H2(g) ΔH3<0 K3
2CH3OH(g)CH3OCH3(g)+H2O(g),测得CH3OH(g)的浓度随时间(t)的变化如下表:
t/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
c(CH3OH)/(mol·L-1) | 1.00 | 0.65 | 0.50 | 0.36 | 0.27 | 0.20 | 0.20 |
①10~30 min内,用CH3OCH3(g)表示该反应的平均速率为。
②反应达平衡时,容器内的压强为P0。该反应在200 ℃时的平衡常数Kp=(以分压表示,分压 = 总压×物质的量分数)。
③200 ℃时,向该容器中投入三种成分的浓度如下:
物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
c/(mol·L-1) | 0.54 | 0.68 | 0.68 |
该时刻,正、逆反应速率的大小关系为:v正(CH3OH)v逆(CH3OH)(填“>”“<”或“=”)。
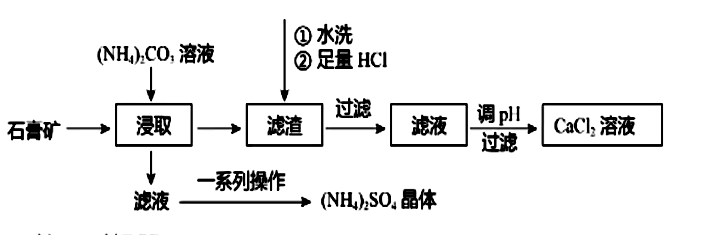
金属离子 | Fe3+ | Al3+ | Ca2+ |
开始沉淀的pH | 1.8 | 3.4 | 11.3 |
沉淀完全的pH | 3.2 | 4.8 | … |
pH=8.3时,Al(OH)3开始溶解 | |||
则“调pH”中需要调节的pH范围。
化学键 | C—H | C=C | C—C | H—H |
键能/(kJ/mol) | 414.4 | 615.3 | 347.4 | 435.3 |
该反应的反应热ΔH=。
![]()
①绿矾为 , 反应(Ⅰ)中
与FeSO4的物质的量之比为。
②常温下若处理后的废水中 , 则处理后的废水的
。

①A电极上发生的反应为 。
②若放电一段时间后,消耗氧气2.24 L(标准状况),理论上外电路
转移电子的物质的量为。
电解合成1,二氯乙烷
的实验装置如图所示。回答下列问题:

①离子交换膜X为交换膜(填“阳离子”或“阴离子”);
②阴极区的电极反应式是 。
C6H8O6+I2═C6H6O6+2H++2I﹣ . 回答下列问题:
①配制:配制一定浓度的I2标准溶液。碘水见光易分解,配制好的I2标准溶液应保存在 色试剂瓶中。
②标定:标定碘液的Na2S2O3溶液在酸性条件下不稳定,溶液容易出现浑浊,该反应的离子方程式为,因此配制时往往调溶液至碱性。用Na2S2O3标准溶液标定①中配制的I2标准溶液,计算得I2标准溶液浓度为0.05000mol•L﹣1。
准确称取2.000g维生素C药片,磨成粉末,配制成250mL溶液,取25.00mL至锥形瓶,用I2标准溶液进行滴定,用淀粉作指示剂。
①维生素C很容易被氧气氧化,因此需往该待测液中加入来保存。
A.醋酸溶液 B.硝酸溶液 C.碳酸钠溶液 D.烧碱溶液
②确定时应选择(填“酸式“或“碱式”)滴定管盛装I2标准溶液。
滴定终点的现象是。
③维C含量的计算
实验过程中测得数据如表:
编号 | 1 | 2 | 3 | 4 |
V(I2标准溶液)/mL | 20.80 | 20.81 | 21.70 | 20.79 |
根据以上数据可得,该药片中维C的质量分数为。