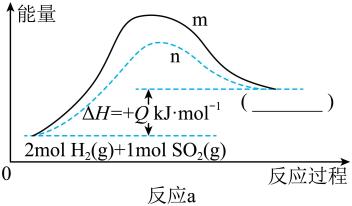
①曲线(填“m”或“n”)表示的是有催化剂参与反应的过程。
②图中括号内应该填写。
向恒温恒容密闭容器中充入一定量的CO和 , 发生反应b。下列描述可判断该反应达到平衡状态的是____。
①0~tmin内,
②该温度下,反应b的平衡常数
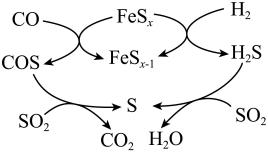
该方法的部分反应过程如图所示。下列说法合理的是____。

请回答下列问题:
①A为氯气发生装置,发生反应的离子方程式是。(高锰酸根离子被还原为)。
②除杂装置B中盛放的试剂是,装置D的作用是。
③C中得到紫色固体和溶液,C中发生的反应有:
, 另外还有。(用化学方程式表示)
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有。为证明是否是
氧化了
而产生
, 设计以下方案:
方案I | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。 |
方案II | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将 |
I.由方案I中溶液变红可知溶液a中含有离子。
II.方案II可证明氧化了
。用KOH溶液洗涤的目的是排除(填离子符号)的干扰。
②根据的制备实验可判定,氧化性:
(填“>”或“<”);而方案II实验表明,
和
的氧化性强弱关系与上述判定相反,原因是。