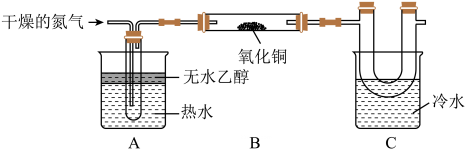
回答下列问题:
猜想1:固体为铜
猜想2:固体为氧化亚铜
猜想3:固体为铜和氧化亚铜的混合物
①甲同学取少量反应后的固体,加入足量的稀硫酸中,固体部分溶解,溶液变蓝,则猜想不成立。
②乙同学取少量反应后的固体,加入稀硝酸中,固体全部溶解,得出猜想2成立,其他同学对此提出质疑,理由是。
③在老师的指导下,丙同学取20 g反应后的固体于试管中,加入足量稀硫酸,充分反应后,过滤、、干燥,称量得知干燥后的固体为18 g,得出猜想成立。
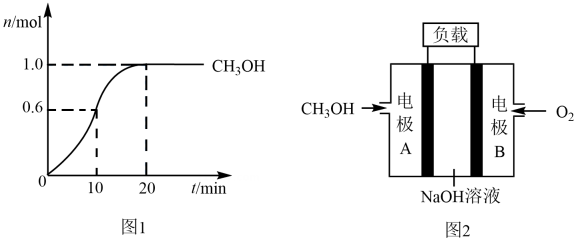
a.0~10 min内,反应物浓度更大
b.0~10 min内,容器内温度较低
c.0~10 min内,生成物浓度更大
a.容器内温度不随时间的变化而变化
b.混合气体中各成分浓度之比为
c.单位时间内消耗a mol , 同时生成a mol
d.混合气体的平均相对分子质量不随时间的变化而变化
CH,