

卤素单质及其化合物在科研和工农业生产中有着广泛的应用。回答下列问题:
a. b.
c.
d.
②一氯乙烷、一氯乙烯
、一氯乙炔
分子中,
键长的顺序是,理由:(ⅰ)C的杂化轨道中s成分越多,形成的
键越强;(ⅱ)。

已知阿伏加德罗常数为 , 则
晶体的摩尔体积
(列出算式)。
A. H2O B. CO2 C. SO2 D. CH4
①H3BO3和NH4BF4涉及的四种元素中第二周期元素的第一电离能由大到小的顺序(填元素符号)。
②H3BO3本身不能电离出H+ , 在水中易结合一个OH﹣生成[B(OH)4]﹣ , 而体现弱酸性。[B(OH)4]﹣中B原子的杂化类型为。
③NH4BF4(四氟硼酸铵)可用作铝或铜焊接助熔剂、能腐蚀玻璃等。四氟硼酸铵中存在(填序号):
A 离子键 B σ键 C π键 D 氢键 E 范德华力

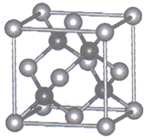
①CuF比CuCl熔点高的原因是;
② 已知NA为阿伏加德罗常数。CuF的晶胞结构如上“图b”。则CuF的晶胞参数a=nm (列出计算式)。
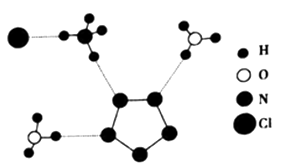
①图中R中阳离子是(填写化学式),相对分子质量较大的阳离子中心原子的杂化类型是。
②图中R中阴离子N5-中的σ键总数为个。分子中的大π键可用符号 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
),则N5- 中的大π键应表示为。
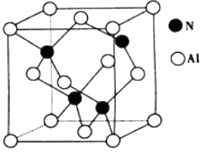
①已知氮化硼与X晶体类型相同,推测氮化硼的熔点比X的熔点(填“高”、“低“ ) ,可能的原因是。
②若X的密度为ρg·cm-3 , 则晶体中最近的两个Al原子的距离为cm。(阿伏加德罗常数的值用NA表示)

①氨基氰CH2N2)分子中C、N 原子均满足8电子稳定结构,则该分子的结构式为;该分子为(填“极性”或“非极性”)分子。
②氨基氰易溶于水或乙醇,其主要原因是。
③关于g- C3N4的叙述正确的是。
A.电负性:C>N
B.该物质的熔点比石墨更高
C.该物质属于原子晶体
D.该物质中C和N原子均采取SP2杂化

①NH3的空间构型为。
②[Zn(NH3)6]2+离子中存在的化学键类型有;NH3分子中H-N-H键角为107.3°,判断[Zn(NH3)6]2+离子中H-N-H 键角107.3°( 填">”、"<”或“=”)。
③肼(N2H4)可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物。与N2H4互为等电子体的分子有。(写一种)

①Xn+中所有的电子恰好充满K、L、M 三个电子层,则基态X原子的价电子的轨道表示式为。
②已知该晶体的密度为5.84g·cm-3 , 则阿伏加德罗常数NA的计算表示式为(含a)。

①已知 和O的电负性分别为1.65、3.5,
中化学键类型为,
可以与
溶液溶解生成
,请从化学键角度解释能形成该离子的原因。
②一种 晶体的晶胞(立方体)如图3所示,
为阿伏加德罗常数的值,
原子半径为
。图4是沿着立方格子对角面取得的截图,则
原子与O原子间最短距离x=
。晶体的密度为
(列出计算式即可)。

|
元素 |
Cl |
Cu |
|
电负性 |
3.2 |
1.9 |



②晶胞参数:描述晶胞的大小和形状。已知CaF2晶体的密度为cg·cm-3 , 则晶胞中Ca2+与离它最近的F-之间的距离为nm (设NA为阿伏加德罗常数的值,用含C、NA的式子表示;相对原子质量:Ca 40 F 19)。