
请回答下列问题:

(7钼酸根)
(8钼酸根)

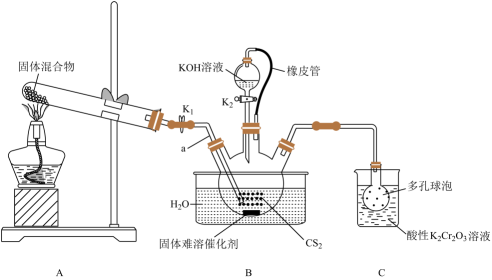
请回答下列问题:
ⅰ.
ⅱ.
写出NO与反应生成
的热化学方程式。
快反应:
;慢反应:
。
①决定总反应速率的是(填“快反应”或“慢反应”)。
②当加入的NO和的物质的量不变,改变温度和压强,NO转化50%时(未达平衡),所需的时间如右表所示。已知:NO和
反应生成
的速率方程为
。k是速率常数,随温度升高而增大,K是快反应的平衡常数。
|
压强/( |
温度/℃ |
时间/s |
|
1 |
30 |
12.5 |
|
90 |
25.8 |
|
|
8 |
30 |
0.20 |
|
90 |
0.60 |
当压强不变,升高温度,总反应速率(填“加快”或“减慢”),理由是。
ⅰ.
ⅱ.
ⅲ.
某模拟废气的直接催化分解(废气中含、
、
、
)。
①℃时,将模拟废气(
体积分数为35%)以5800
的速度通过催化剂,测得N{O的转化率为45%,则平均反应速率v(
)为
。欲提高
的转化率,可采取的措施为适当升温、使用更高效的催化剂、增大催化剂表面积或厚度、。
②℃和p kPa时,在恒压密闭容器中进行实验。各组分的相关数据如下表,该温度下反应ⅰ压强平衡常数
kPa(保留到小数点后1位)。
物质 | NO | |||||
投料/mol | 37 | 19 | 21 | 6.5 | 0 | 0 |
平衡/mol | 51 | 21 | 20 | 2 | 4 |

阳极附近溶液中发生的离子方程式为。

请回答下列问题: