|
|
|
|
|
| A.制备CO2 | B.制备NaHCO3 | C.加热NaHCO3固体 | D.检测产品中是否含有NaHCO3 |

a.原子半径 b.氢化物的稳定性
c.单质的氧化性 d.元素的非金属性
ClO2气体可处理污水中的CN- , 以下是ClO2的两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O

用蛋壳样品重复实验,实验数据记录在表中。
蛋壳样品质量 | 0.200g |
反应前压强 | 0.800atm |
反应后压强 | 0.870atm |
a.30% b.45% c.60% d.75%
a.0.0020 b.0.050 c.0.50 d.1.0
a.用2.0mol•L-1CH3COOH(aq)代替2.0mol•L-1HCl(aq) b.将HCl(aq)冷却到比原实验更低温度
c.选择体积更小的反应容器 d.将蛋壳研磨成更小的粉末
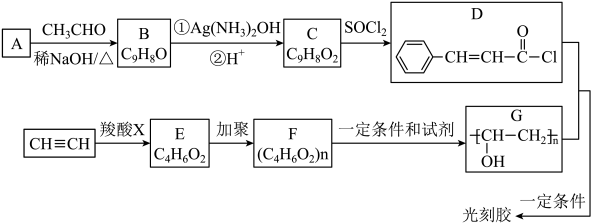
已知:A是苯甲醛(![]() )
)
I. ![]() +
+ ![]()
![]() (R1 , R2为烃基或氢)
(R1 , R2为烃基或氢)
II. ![]() +R2OH
+R2OH
![]() +HCl(R1 , R2为烃基)
+HCl(R1 , R2为烃基)
①既能发生银镜反应,又能发生水解反应;
②苯环上的一氯取代产物只有两种。
写出该同分异构体的结构简式:。
浓度(mol•L-1) | 时间(min) | |||||
0 | 10 | 20 | 30 | 40 | 50 | |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
a.该反应体现了NO的氧化性 b.降低NO浓度能够减慢反应速率
c.加入足量的炭粉可以使NO100%转化 d.合适的催化剂可以加快反应速率
a.加入一定量的活性炭 b.通入一定量的NO
c.适当缩小容器的体积 d.加入合适的催化剂
某实验室模拟该反应,在恒压密闭容器中加入足量的活性炭和一定量的NO气体,测得NO的转化率随温度的变化如图所示:
