实验操作:向小试管中加入溶液,并滴入两滴淀粉溶液,无明显变化,再加入少量
溶液,试管中溶液立即变蓝。取上层清液检验,证明溶液中存在
。
已知:可与
发生反应:
。为了进一步探究
与
的反应速率,小组同学设计下表实验:
试验编号 |
|
| 蒸馏水/ | 0.4%的淀粉溶液/滴 |
| 变色时间/ |
Ⅰ | 4.0 | 0 | 4.0 | 2 | 2.0 | 立即 |
Ⅱ | 4.0 | 1.0 | 3.0 | 2 | 2.0 | 30 |
加入溶液后溶液变蓝的时间明显增长,小组同学对此提出两种猜想:
猜想1:先与
反应,
消耗完后才与
反应;
猜想2:与
反应的速率远低于
与
反应的速率。
为验证上述猜想,小组同学补充下表实验:
试验编号 |
|
|
| 0.4%的淀粉溶液/滴 |
| 实验现象 | |
Ⅲ | 2 | 0 | 20 | 10 | 0 | 0.2 | 下层溶液显浅紫色 |
Ⅳ | 0 | 5 | 20 | 0 | 2 | 20 | 溶液先变蓝,后迅速褪色,一段时间后又变蓝 |
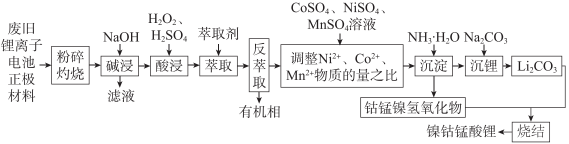
已知:①粉碎灼烧后主要成分是、
、
、MnO、Fe2O3、
;
②萃取剂对选择性很高,且生成的物质很稳定,有机相中的
很难被反萃取
请回答下列问题:
开始沉淀时pH | 1.5 | 3.4 | 6.3 | 6.6 | 6.7 | 7.8 |
完全沉淀时pH | 3.5 | 4.7 | 8.3 | 9.2 | 9.5 | 10.4 |
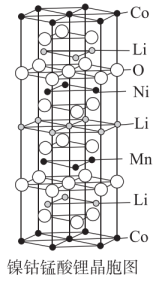
①该物质的化学式为,写出基态Mn原子价层电子的轨道表示式。
②已知晶胞底面边长是anm,高是bnm,一个晶胞的质量为Mg,计算该晶胞的密度(用计算式表示)。
反应Ⅰ:
反应Ⅱ:
化学键 | ||||
键能 | 436 | 1071 | 464 | 803 |
②若K1、K2分别表示反应Ⅰ、反应Ⅱ的平衡常数,则的平衡常数K=(用含K1、K2的代数式表示)。
③已知的正反应速率
( k为正反应的速率常数),某温度时测得数据如下:
1 | 0.02 | 0.01 | |
2 | 0.02 | 0.02 | a |
则此温度下表中a=。

