稀硫酸的配制
①配制的
溶液,需
溶液的体积为mL。
②在实验室配制上述溶液的过程中,下图所示仪器,需要用到的是(填仪器名称)。

【实验任务】利用相关原电池装置进行实验,探究物质氧化性或还原性的影响因素。
【查阅资料】其他条件相同时,参与原电池反应的氧化剂(或还原剂)的氧化性(或还原性)越强,原电池的电压越大。
【进行实验】
利用下表所示装置进行实验1~4,记录数据。
装置 | 实验序号 | 烧杯中所加试剂 | 电压表读数 | ||
| 30% | ||||
1 | 30.0 | / | 10.0 | ||
2 | 30.0 | 1.0 | 9.0 | ||
3 | 30.0 | 2.0 | 8.0 | ||
4 | 35.0 | 1.0 | |||
已知:本实验条件下,对电压的影响可忽略。
①根据表中信息,补充数据:。
②由实验2和4可知,(填“大于”或“小于”或“等于”),说明其他条件相同时,
溶液的浓度越大,其氧化性越强。
猜想1:酸性条件下,的氧化性随pH减小而增强。
猜想2:酸性条件下,Cu的还原性随pH减小而增强。
为验证猜想,小组同学在(3)中实验1~4的基础上,利用下表装置进行实验5~-7,并记录数据。
装置 | 实验序号 | 操作 | 电压表读数 |
| 5 | / | |
6 | ①向(填“左”或“右”)侧烧杯中滴加 | ||
7 | 向另一侧烧杯中滴加 |
②实验结果为:、,说明猜想2不成立,猜想1成立。
【实验结论】物质的氧化性(或还原性)强弱与其浓度、pH等因素有关。
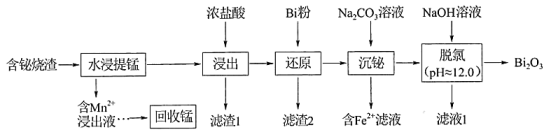
已知:①氧化性:;
②易水解成BiOCl沉淀;常温下,BiOCl存在的pH范围约为2.0~11.0;
③常温下,;
。
回答下列问题:
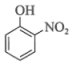 )的熔点,其原因是。
)的熔点,其原因是。
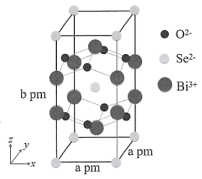
①该晶胞沿z轴方向的投影图为(填标号)。
A.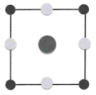 B.
B. C.
C. D.
D.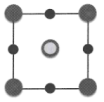
②该晶体中,每个周围紧邻的
共有个。
③该晶体的密度为(列出计算式,
为阿伏加德罗常数的值)。
反应I:
已知:
反应II: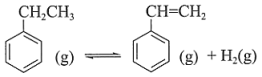
反应III:
回答下列问题:
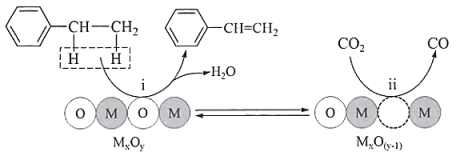
该机理可表示为以下两个基元反应,请补充反应ⅱ:
ⅰ:
;
ⅱ:.
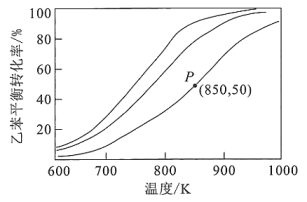
①乙苯平衡转化率相同时,投料比越高,对应的反应温度越(填“高”或“低”)。
②相同温度下,投料比远大于10∶1时,乙苯的消耗速率明显下降,可能的原因是:
ⅰ.乙苯的浓度过低;
ⅱ.。
③850K时,反应经t min达到图中P点所示状态,若初始时乙苯的物质的量为n mol,则v(苯乙烯)=。