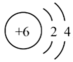
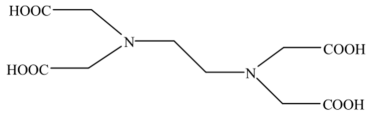
 , 可以表示
, 可以表示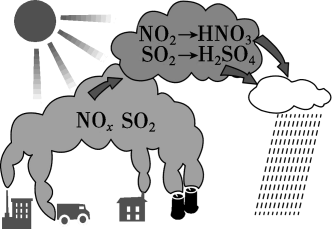
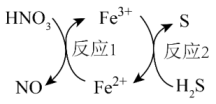

 说法正确的是( )
说法正确的是( )
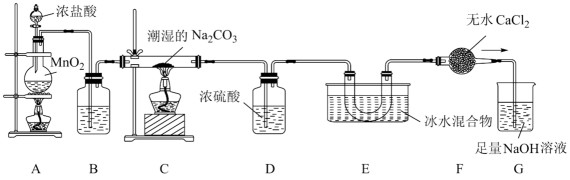
已知:常温下,Cl2O是棕黄色、有刺激性气味的气体,易溶于水;熔点:-120.6℃;沸点2.0℃。
温度/℃ | 纯碱含水量/% | Cl2O收率/% |
0~10 | 5.44 | 67.85 |
0~10 | 7.88 | 89.26 |
10~20 | 8.00 | 64.24 |
30~40 | 10.25 | 52.63 |
30~40 | 12.50 | 30.38 |
已知:。
序号 | 实验 | 试剂 | 混合液pH | 现象 |
Ⅰ |
| NaOH | 10 | 常温产生银镜 |
Ⅱ | 浓氨水 | 10 | 加热无银镜 | |
Ⅲ | 无 | 8 | 加热才能产生银镜 |
①对比实验和,证实了文献的说法。
②实验Ⅱ未产生银镜,结合以下机理简要分析原因。
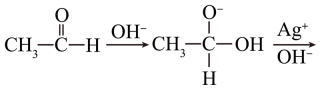 CH3COO-+Ag
CH3COO-+Ag
实验Ⅳ:向银氨溶液中加入NaOH溶液至pH=14,得到棕黑色沉淀,振荡后将试管放在热水浴中温热,有气泡产生,试管内壁产生银镜。
①实验Ⅳ中,将Ag元素还原的离子可能是。
②经检验棕黑色沉淀Y中含有Ag单质,请设计实验方案验证:。