
【资料查阅】磷化锌易水解产生PH3;PH3沸点为-88℃,有剧毒性、强还原性、易自然。
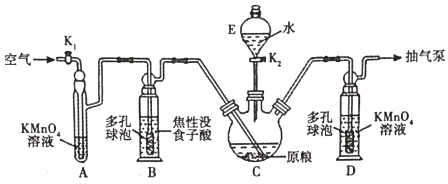
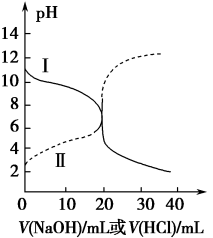
【用量标准]如图:装置A、B、E中盛有的试剂均足量;C中装有100原粮;D中盛有40.00mL6.0×10-5mol・L-1KMnO4溶液(H2SO4酸化)。
【操作流程】安装仪器并检查气密性→PH3的产生与吸收一转移KMnO4吸收溶液→用Na2SO3标准溶液滴定。
试回答下列问题:
a.实验前,将C中原粮预先磨碎成粉末
b.将蒸馏水预先煮沸、迅速冷却并注入E中
c.实验过程中,用抽气泵尽可能加快抽气速率
甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
易溶于水,微溶于乙醇,两性化合物 | 易溶于水和乙醇,有强酸性和还原性 | 易溶于水,难溶于乙醇 |
向绿矾溶液中,缓慢加入NH4HCO3溶液,边加边搅拌,反应结束后生成沉淀FeCO3。该反应的离子方程式为。
①加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是。
②洗涤操作,选用的最佳洗涤试剂是(填序号)。
A.热水 B.乙醇 C.柠檬酸
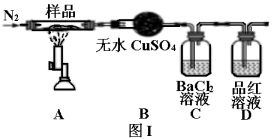
加热前通入氮气的目的是。
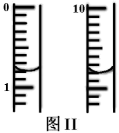
称取m g绿矾样品于锥形瓶中溶解后加稀H2SO4酸化,用 c mol·L−1 KMnO4 溶液滴定至终点。耗KMnO4溶液体积如图II所示,(滴定时发生反应的离子方程式为:5Fe2++MnO4−+8H+=5Fe3++Mn2++4H2O),该晶体中铁元素的质量分数为(用含m、c的式子表示)。