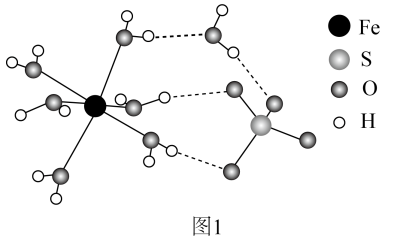
①的价层电子排布式为。
②中O和
中S均为
杂化,比较
中
键角和
中
键角的大小并解释原因。
③中
与
与
的作用力类型分别是。
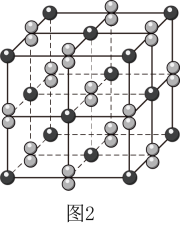
①距离最近的阴离子有个。
②的摩尔质量为
, 阿伏加德罗常数为
。
该晶体的密度为。
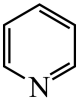 )替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的
)替代苯也可形成类似的笼形包合物。已知吡啶中含有与苯类似的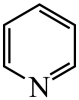 、
、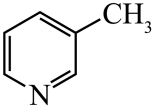 、
、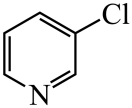 的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。
的碱性随N原子电子云密度的增大而增强,其中碱性最弱的是。

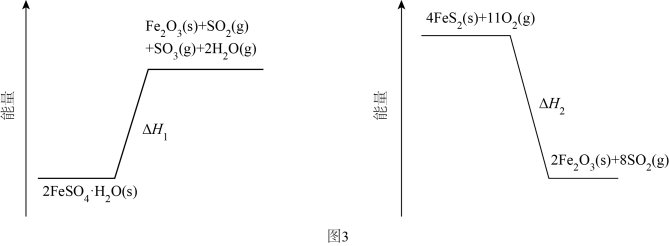
研究发现,给小鼠喂食适量硒酸钠( )可减轻重金属铊引起的中毒。
的立体构型为。

①X的化学式为。
②设X的最简式的式量为 ,晶体密度为
,则X中相邻K之间的最短距离为
(列出计算式,
为阿伏加德罗常数的值)。
铁和硒( )都是人体所必需的微量元素,且在医药、催化、材料等领域有广泛应用。回答下列问题:

①基态 原子的核外电子排布式为
;
②该新药分子中有种不同化学环境的C原子;
③比较键角大小:气态 分子
离子(填“>”“<”或“=”),原因是。

①富马酸分子中 键与
键的数目比为;
②富马酸亚铁中各元素的电负性由大到小的顺序为。

①产物中N原子的杂化轨道类型为;
②与 互为等电子体的一种分子为(填化学式)。

①该超导材料的最简化学式为;
② 原子的配位数为;
③该晶胞参数 、
。阿伏加德罗常数的值为
,则该晶体的密度为
(列出计算式)。