| 第一次 | 第二次 | 第三次 |
滴定前 | 0.00 | 1.00 | 2.00 |
滴定后 | 9.90 | 11.00 | 12.10 |
下列说法错误的是

①六方氮化硼的化学式为,其晶体中存在的作用力有(填字母序号)。
a、范德华力 b、键 c、离子键
②石墨能导电的主要原因是电子能在由电负性相同的碳原子所形成的大键中流动。但六方氮化硼晶体不导电,可能的原因是。

①晶胞中平均含有个硼原子,距离硼原子最近的氮原子有个。
②已知:立方氮化硼晶体的摩尔质量为 , 密度为
, 设
为阿伏加德罗常数的值,则该晶体的晶胞边长为cm。

已知:ⅰ、 (G为
(G为或OR′)
ⅱ、
ⅲ、
 的化学方程式是。
的化学方程式是。
a、异诺卡酮易溶于水
b、异诺卡酮中有手性碳原子
c、E的红外光谱中会出现碳碳双键、酮羰基、酯基的特征吸收峰
d、E存在含苯坏且苯环上只有一种化学环境氢的同分异构体


已知:选择性(S)和法拉第效率(FE)的定义:
×100%;
×100%
①补全阴极产生的电极反应
![]() _+
_+![]() _
_![]() _。
_。
②阴极附近发生反应(用离子方程式表示),生成的难以放电,降低了。结合上述信息,
的理论最大值为。
③结合化学用语分析阳极区产生的原因是。

①结合图3的变化规律,推测可能的作用是。
②时,
(已折合为标准状况,下同)的
被完全吸收并还原为
和
, 分离
后,将
和
混合气体通入如图4所示装置(反应完全),出口处收集到气体
。则
为。

已知:①不溶于水、稀酸和碱溶液;②
能与强酸、强碱反应。
盐酸酸浸过程中发生反应的离子方程式为。
a、滤渣1的主要成分为、
b、若将流程A部分与流程B部分互换顺序,最终得到的滤渣成分相同
c、若将流程A部分与流程B部分互换顺序,理论上氢氧化钠用量不变
ⅰ、配制金属浸取液:取一定量的亚硫酸钠和邻菲岁啉(抑制
水解)溶于水,加入乙酸和乙酸铵混合溶液调
, 此时铁的化合物不溶解。
ⅱ、取粉碎后的含钛高炉渣,加入足量金属
浸取液,室温下浸取
。
ⅲ、过滤,将滤液及洗涤液全部转移至盛有过量溶液的烧杯中,加入稀硫酸充分反应。
ⅳ、将反应后的溶液煮沸至冒大气泡并继续微沸。
ⅴ、冷却,用浓度为的抗坏血酸
标准液滴定,消耗抗坏血酸标准液
。
已知:①酸性条件下,(未配平)
②(抗坏血酸)
(脱氢抗坏血酸)
步骤ⅱ中浸取铁时发生反应的离子方程式为。
情况一:配制金属浸取液时,溶液
等于2
情况二:未进行步骤ⅳ,直接用抗坏血酸标准液滴定
①情况的测定结果(填“偏高”或“偏低”)。
②理由是。
将等体积、低浓度的溶液(已用稀盐酸酸化)和
溶液混合,静置至体系达平衡,得红色溶液a。各取
溶液a放入3支比色皿中,分别滴加
不同浓度的
溶液,并测定各溶液的透光率随时间的变化,结果如图所示。
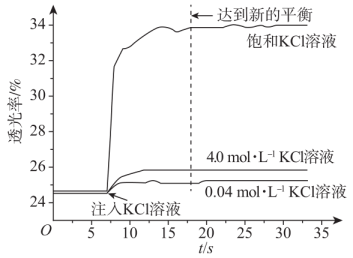
已知:①溶液的透光率与溶液颜色深浅有关,颜色深,透光率低。
②在水溶液中由于水解而显黄色;
溶液中存在
(黄色)。
稀盐酸酸化溶液的目的是。采用浓度较低的
溶液制备
和
平衡体系,是为了避免(填离子符号)的颜色对实验干扰。
同学查阅相关资料,认为可能的原因有:
原因1:溶液中的离子会受到周围带有异性电荷离子的屏蔽,使该离子的有效浓度降低,这种影响称为盐效应。溶液的加入使
和
平衡状态因盐效应而发生变化。
原因2:溶液中存在副反应 , 离子浓度发生变化,导致
和
平衡状态发生变化。
基于以上分析,该组同学取等体积的溶液a,分别加入等物质的量的不同种类的盐晶体(忽略溶液体积变化),观察颜色变化,结果如下表。
序号 | 加入少量盐 | 溶液颜色 |
1 | 无 | 红色 |
2 | 变浅 | |
3 | 略变浅 | |
4 | 变浅程度较大 |
①上述实验可证明盐效应影响了和
平衡体系的是(填字母序号)。
a、1和2 b、1和3 c、1和4
②选择实验(填序号)可得出结论:的盐效应弱于
的盐效应。简述选择实验的理由及获得结论的依据:。
序号 | 加入溶液 | 溶液颜色 |
5 |
| 明显变浅,溶液偏黄 |
6 |
| 略变浅 |
上述实验可证明副反应影响了和
平衡体系,结合实验现象及化学用语分析副反应对
和
平衡体系有影响的原因:。
在不同浓度
溶液中的溶解度数据如下表:
0 | 0.01 | 0.02 | 0.04 | 0.10 | 0.20 | |
| 4.5 | 0.48 | 0.42 | 0.39 | 0.48 | 0.69 |
分析在
范围内,
溶解度发生变化的原因:。