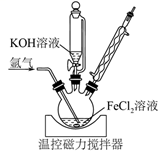
完成下列填空:
完成下列填空:

称取1.023 g NaBO3·4H2O(M=153.86 g·mol-1)加入20.0 mL 1 mol·L-1 H2SO4(aq)酸化后定容至100 mL,取出10.00 mL用0.01046 mol·L-1 的KMnO4(aq)滴定至终点,消耗KMnO4(aq) 24.34 mL。
已知:① BO3-+2H2O=H2O2+H2BO3-
② MnO4-+H2O2+H+→Mn2++O2↑+H2O(未配平)
2MnO4-+5H2O2+_H+=_Mn2++_O2↑+_H2O

完成下列填空:
C3H8的转化率随温度升高而上升的原因是,写出一条提高C3H6产率的措施。
已知:C3H8(g)→CH4(g)+C2H2(g)+H2(g)+a kJ;C3H6(g)→CH4(g)+C2H2(g)+b kJ
用含a、b的代数式表示Q=。
C3H8(g)→C3H6(g)+H2(g)。经相同时间,流出的c(C3H6)、c(CO)和c(H2)随初始c(CO2)的变化关系如图。结合化学方程式解释c(H2)和c(C3H6)变化差异的原因。


a.适当提高反应温度 b.改变催化剂
c.适当降低反应温度 d.改变反应物浓度