 B . 稀释浓硫酸
B . 稀释浓硫酸  C . 检查装置气密性
C . 检查装置气密性  D . 粗盐提纯
D . 粗盐提纯 
| 加入的物质 | NaOH溶液 | 稀盐酸 | AgNO3溶液 |
| 实验现象 | 蓝色沉淀 | 无明显现象 | 白色沉淀 |



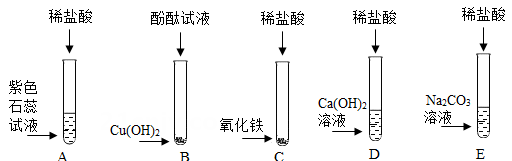

①在止水夹K1、K2处于关闭状态时,将针筒A中溶液挤入试管B中,接着打开止水夹K1 , 发现D中的部分溶液吸入试管B中,充分反应后,试管B留下的溶液也显红色。
②再打开止水夹K2 , 风哨振动鸣叫,C中的部分溶液被吸入B和D中,反应后B、D中溶液都变为无色。
回答:
【提出问题】废液中的溶质是什么物质?
【作出猜想】小红认为废液中溶质只有CaCl2;
小明认为废液中溶质是CaCl2和HCl
【查阅资料】CaCl2溶液呈中性;Ca(OH)2微溶于水
【实验与结论】小红从废液缸中取少许上层清液(下称“废液”),滴入1-2滴无色酚酞试液,酚酞试液不变色。
小明也取少许废液,向其中加入少量的氧化铜粉末,充分反应,看到的现象是溶液从无色变为蓝色,化学反应方程式是,
综上所述,结论:的猜想是正确的.
在交流与讨论后,小明又取少许废液,向其中逐滴滴加碳酸钠溶液,并不断振荡,反应现象是.
A.只看到有大量气泡冒出 B.只有白色沉淀析出
C.开始出现白色沉淀,后冒气泡 D.开始冒气泡,后出现白色沉淀

【原理思路】利用碳酸钠与稀硫酸反应产生CO2 , 通过CO2 质量的测定,确定样品中碳酸钠的质量,从而计算烧碱样品纯度。
①加入的稀硫酸量不足 ②装置内空气中的CO2没有排出
③反应产生的CO2未被完全吸收 ④干燥管与空气直接相通
A.打开a,b 关闭c B.打开a,c 关闭b
【提出问题】
氢氧化钠溶液中通入二氧化碳一段时间后,溶液中会有什么溶质?
【查阅资料】
⑴通入少量的二氧化碳时,NaOH与CO2反应生成Na2CO3;
⑵通入过量的二氧化碳时,反应的化学方程式为Na2CO3+CO2+H2O=2NaHCO3;
⑶碳酸氢盐都能溶于水,BaCO3难溶于水且是白色固体;
⑷Na2CO3、NaHCO3的溶液呈碱性、BaCl2呈中性;
⑸NaHCO3与盐酸能反应,与BaCl2不能反应。
【提出猜想】
⑴溶质有NaOH、Na2CO3;
⑵溶质为Na2CO3;
⑶溶质是(填化学式);
⑷溶质全部是NaHCO3
【设计实验方案】
|
实验步骤 |
实验现象 |
实验结论 |
|
①用试管取少量小烧杯中反应后的溶液,滴加几滴酚酞试液 |
溶液变红色 |
该溶液显碱性 |
|
②将小烧杯中反应后剩下的溶液进行称量,然后滴加过量的BaCl2溶液 |
有 生成 |
猜想(4)不成立 |
|
③取步骤②静置后的上层清液,滴入稀盐酸 |
有气泡冒出 |
猜想(1)和(2)不成立 |
【得出结论】猜想(3)成立
【讨论交流】
有同学提出实验步骤①是多余的。你认为该实验设计是否需要?并说明理由 。
|
实验次数 |
1 |
2 |
3 |
4 |
5 |
|
稀盐酸的累计加入量/g |
5.0 |
10.0 |
15.0 |
20.0 |
25.0 |
|
剩余固体的质量/g |
1.5 |
1.0 |
0.5 |
0.3 |
0.3 |
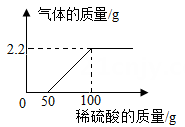
请计算: