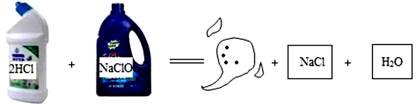
| 溶液 | 甲+乙 | 乙+丙 | 丙+丁 | 甲+丁 |
| 现象 | 无明显现象 | 白色沉淀 | 白色沉淀 | 无色气体 |
根据对上述现象的分析,可推知甲、乙、丙、丁四种溶液的顺序依次是( )
| 选项 | 物质 | 杂质 | 除去杂质的方法 |
| A | C | CuO | 加入足量稀硫酸,过滤、洗涤、干燥 |
| B | NaCl | Na2CO3 | 加入足量稀硫酸,蒸发结晶 |
| C | CO2 | CO | 通过氢氧化钠溶液 |
| D | MnO2 | KCl | 加水溶解、过滤、蒸发 |
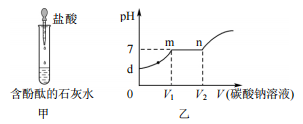
【建立猜想】①两种酸溶液的pH不同.(注:pH相同,则单位体积溶液中H+数目相同)
②两种酸溶液中的不同.
【实验过程】
|
实验次数 |
试剂 |
实验条件 |
实验现象 |
|
1 |
0.2gCuO粉末+6mLpH=0的盐酸 |
常温 |
黑色粉末溶解,溶液呈蓝绿色 |
|
2 |
0.2gCuO粉末+6mLpH=0的硫酸 |
常温 |
无明显现象 |
|
3 |
0.2gCuO粉末+6mLpH=0的硫酸+0.35gNaCl |
常温 |
黑色粉末溶解.溶液呈蓝绿色 |
|
4 |
0.2gCuO粉末+6mLpH=0的硫酸+0.35g |
常温 |
无明显现象 |
【实验结论】常温下,pH相同的盐酸和硫酸溶液于CuO反应现象出现差异的原因是由于促进了反应的进行.


请根据流程图回答:①操作Ⅰ的名称是;试剂B的化学式:。
②写出加入试剂A后反应的化学方程式:。
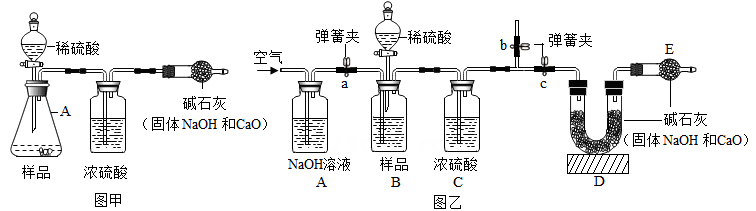
【原理思路】利用碳酸钠与稀硫酸反应产生CO2 , 通过CO2 质量的测定,确定样品中碳酸钠的质量,从而计算烧碱样品纯度。
①加入的稀硫酸量不足 ②装置内空气中的CO2没有排出
③反应产生的CO2未被完全吸收 ④干燥管与空气直接相通
①KCl; ②NH4HCO3; ③Ca3(PO4)2 .

请回答下列有关问题:

I.取样品 40g,倒入容积为 200mL 的锥形瓶中,然后在分液漏斗中加入水,置于电子天平上测出总质量 m1。
II.打开活塞,加入足量的水充分反应,直到没有固体剩余,静置一段时间,测出总质量 m2。
III.实验数据如表。
请根据以上信息求样品中铝的质量分数。
|
反应前总质量m1 |
反应后总质量m2 |
|
372.44g |
371.24g |
将过量的稀盐酸加入20g大理石中(其他成分不与盐酸反应),把产生的CO2气体用足量的烧碱将液吸收,同时测量C瓶烧碱溶液增加的质量,结果如下表所示:
|
时间/分 |
0 |
2 |
4 |
6 |
8 |
10 |
12 |
|
C增加质量/g |
0 |
3.0 |
5.0 |
6.0 |
6.6 |
X |
6.6 |
