
| 花的种类 | 花汁在酒精中的颜色 | 花汁在酸溶液中的颜色 | 花汁在碱溶液中的颜色 |
| 玫瑰 | 粉红色 | 粉红色 | 绿色 |
| 万寿菊 | 黄色 | 黄色 | 黄色 |
| 雏菊 | 无色 | 无色 | 黄色 |
则下列说法中正确的是( )



 B .
B .  C .
C .  D .
D . 
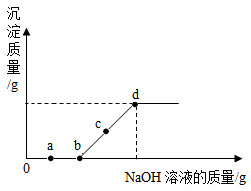
AlCl3+ 3NaOH = Al(OH)3↓+ 3NaCl ,Al(OH)3 + NaOH = NaAlO2 + 2H2O ,NaAlO2易溶于水。
下列图像正确的是( )
 B .
B .  C .
C .  D .
D . 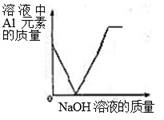
|
项目 |
检测值 |
正常pH范围 |
|
血浆 |
7.4 |
7.35-7.45 |
|
胃液 |
0.8 |
0.9-1.5 |
|
胆汁 |
7.21 |
7.1-7.3 |
|
胰液 |
7.8 |
7.5-8.0 |




【实验操作】取一块状石灰石于试管中,往试管中加入5毫升稀盐酸。
【实验现象】①开始时固体表面有大量气泡;②反应停止后,试管底部有块状固体残留、固体表面无气泡;③试管内溶液无色。
【初步分析】⑴反应停止后,某同学根据上述实验现象进行初步判断,得出了石灰石没有反应完的结论。支持该同学得出这一结论的依据是(填上述实验现象的序号)。
【小组讨论】大家讨论后认为,要判断是否恰好完全反应,可以从液体和固体两条途径进行探究:一是探究残留液体中是否还有盐酸;二是探究残留块状固体中是否还有碳酸钙。
【继续探究】⑵对原残留液体是否还有盐酸的探究,有同学取原残留液体,滴加AgNO3溶液,产生白色沉淀,再滴加稀硝酸沉淀不溶解。于是根据这一现象,得出了原残留液体中存在盐酸的结论。但小金认为根据这一现象是不能得出原残留液中存在盐酸的结论。
⑶探究原残留液体中是否还有盐酸,真正需要检验的离子是;
⑷探究残留块状固体中是否还有碳酸钙。小丽取原残留块状固体用水洗净后加入稀盐酸,将产生的气体通入澄清石灰水,出现了的现象,于是得出残留块状固体中还存在碳酸钙。
【实验结论】在原反应结束时,稀盐酸与石灰石没有恰好完全反应,石灰石中碳酸钙有剩余。
【实验目的】确定白色固体的组成
【实验方案】
【实验结论】该白色固体由NaHCO3和NaCl两种物质组成




【提出问题】这瓶试剂是什么?
【讨论、猜想】可能是Na2SO4溶液;也可能是NaOH溶液;还可能是……。
【设计与实验】
|
操作步骤 |
实验现象 |
|
取样于试管中,滴入溶液; |
|
|
实验编号 |
氯化镁溶液浓度/g•L﹣1 |
反应温度/℃ |
Mg(OH)2转化率/% |
|
a |
20 |
30 |
27.06 |
|
b |
40 |
30 |
56.77 |
|
c |
40 |
40 |
69.64 |
|
d |
40 |
60 |
54.30 |
|
e |
60 |
60 |
50.60 |


