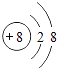 B .
B . 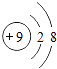 C .
C .  D .
D . 
①该新型材料属于。
A.合成材料 B.复合材料 C.天然材料 D.无机材料
②传统金属材料冰凉的触感,体现了金属具有的物理性质是。
③氢气作为燃料的优点是 (写一点)。
④由石墨烯的性质,推测其可能的用途有。
A.可作散热材料 B.可作新型充电宝材料
C.优良的绝缘材料 D.新型防弹衣材料
⑤从物质分类的角度看,石墨烯与金刚石一样,都属于 (填“单质”或“化合物”)。
装置如图,b管内产生的气体是,该实验说明水是由元素组成。

生活中经常使用活性炭净水,主要利用活性炭的性。
出),交换后的水仍然呈电中性。

①硬水是溶有较多钙、镁离子的水,写出镁离子的符号。
②已知溶液中阴阳离子所带电荷总数相等,一个镁离子可以交换出个钠离子。
③生活中,将硬水软化的方法为。
【资料】鸡蛋壳的主要成分是碳酸钙,碳酸钙以外的其他成分不与酸反应,也不溶于水。
甲同学用镊子取少许鸡蛋壳样品在酒精灯上灼烧,一开始闻到一股烧焦羽毛气味,说明蛋壳内膜有,将充分灼烧后的蛋壳投入蒸馏水中,此时发生反应的化学方程式为。
[实验二]测定蛋壳中碳酸钙的质量分数将10.00g蛋壳样品(已洗净、干燥并捣碎)放入B装置,再加入100 g稀盐酸(足量)。待不再产生气泡时,称量B装置中剩余物质质量为107.36 g (不考虑其他因素对实验的影响)。回答下列问题:

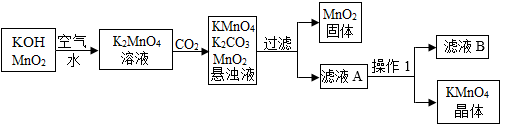
[资料]相关物质的溶解度(20℃) 如表:
物质 | K2CO3 | KMnO4 |
溶解度/g | 111 | 6.34 |

将注射器内液体全部注入集气瓶中充分反应后,观察到,证明氢氧化钠和二氧化碳发生了反应。
图中N溶液的溶质可能是 (写出一种),由此判断氢氧化钠与二氧化碳发生反应依据的现象是。
【资料】
①CO2与乙醇不反应,本实验条件下CO2在乙醇中的溶解忽略不计。
②常温下氢氧化钠易溶于乙醇,碳酸钠微溶于乙醇。
将氢氧化钠的乙醇饱和溶液注入充满CO2的集气瓶中,轻轻振荡,溶液变浑浊。该反应的化学方程式。
兴趣小组的同学将CO2持续通入一定浓度的氢氧化钠溶液中,用数字化实验技术测定反应过程中温度变化,结果如图所示。图中温度变化说明该反应 (填 “放出”或“吸收”)热量。

同学们完善实验后总结如下:对于无明显现象的反应,可以通过验证反应物的减少,如方案;或检验有新物质生成,如方案;或从变化等角度验证反应的发生;还可以通过现代技术手段进行数据测定,实现反应过程的“可视化”。