
已知:①Cl2与KOH溶液的反应是放热反应,在20℃以下反应生成KClO,在较高温度时则生成KClO3;②K2FeO4易溶于水、微溶于浓KOH溶液,在0~5 ℃的强碱性环境中较稳定。
回答下列问题:
已知相关反应为
① +
+2H2O=Fe(OH)3↓+
+OH-;
②2 +2H+=
+H2O;
③ +6Fe2+ +14H+=6Fe3+ +2Cr3+ +7H2O。

回答下列问题:
①硫化过程中,ZnFe2O4与H2、H2S反应生成ZnS和FeS,其化学方程式为。
②硫化一段时间后,出口处检测到COS。研究表明ZnS参与了H2S与CO2生成COS的反应,但反应前后ZnS的质量不变, ZnS的作用是,生成COS的总反应化学方程式为。

①2NO2(g)+H2O(l)=HNO3 (aq) + HNO2(aq) △H1=-116.1 kJ·mol-1;
②3HNO2 (aq)=HNO3(aq) +2NO(g)+H2O(l) △H2=+75.9 kJ·mol-1。
则3NO2(g)+ H2O(l)=2HNO3 (aq)+NO(g)的△H为。
①该反应的平衡常数表达式为Kc= ,0~5 min用N2表示该反应的平均速率为mol· L-1·min-1
②400 ℃时,为提高NO的转化率,应选择的反应条件为(填“增大压强”或“减小压强”)。
t/ min | 0 | 10 | 20 | 30 | 40 |
p/kPa | 36 | 33.8 | 32 | 30.4 | 30.4 |
t=20 min时,体系中H2的分压p(H2)=kPa,NO的平衡转化率为%(保留一位小数)。

①c点时,反应(填“是”或“否”)达到平衡状态。
② (填“>”“=”或“<”)
。


①原子坐标参数表示晶胞内部各原子的相对位置。如图晶胞中,原子坐标参数A(0,0,0);B为( ,
,
);C为(0,1,1)。则D原子的坐标参数为。
②若该晶体的密度是ρg·cm-3 ,则晶胞中两个最近的Fe的核间距为cm(用含ρ的代数式表示,NA表示阿伏加德罗常数的值)。

已知:
①R-CHO R-CH=CHCOOH;
②![]() 。
。
回答下列问题:
①能发生水解反应,水解产物之一能与FeCl3溶液发生显色反应;
②能发生银镜反应,且1 mol X与足量银氨溶液充分反应能生成4 mol Ag;
③X分子中不同化学环境的氢原子个数比是1 : 1 : 2: 6。
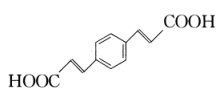 的合成路线:(无机试剂任用)。
的合成路线:(无机试剂任用)。