
已知:RCH=CHCOOR′+![]()

回答下列问题:
①不含—CH3
②含2种官能团
③含苯环,且苯环上仅有2个取代基
④核磁共振氢谱有三组吸收峰,峰面积之比为3∶2∶2
 为原料合成
为原料合成温度/℃ | 压强/MPa | 氨的平衡含量 |
200 | 10 | 81.5% |
550 | 10 | 8.25% |
①该反应为(填“吸热”或“放热”)反应。
②哈伯选用的条件是550℃、10MPa,而非200℃、10MPa,可能的原因是。

①曲线a对应的温度是。
②M、N、Q点平衡常数K的大小关系是。

4NH3(g)+3O2(g)2N2(g)+6H2O(g)ΔH=-1268kJ·mol-1
2NO(g)N2(g)+O2(g)ΔH=-180.5kJ·mol-1
请写出NH3转化为NO的热化学方程式。

资料:
ⅰ.VOSO4高温易分解
ⅱ.含磷有机试剂对溶液中离子萃取能力为Fe(III)>V(IV)>V(V)>Fe(II)
ⅲ.含磷有机试剂萃取过程中溶液的H+浓度越高,萃取率越低,萃取钒效果越差
ⅳ.10VO+8H2O
H2V10O
+14H+
ⅴ.氢氧化物完全沉淀时溶液的pH表
沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
完全沉淀 | 3.2 | 9.0 | 4.7 |
①请结合相关离子方程式,说明加入Na2SO3的第二个作用。
②解释加氨水调节pH≈5的原因是。

称取ag产品,先用硫酸溶解,得到(VO2)2SO4溶液。再加入b1mLc1mol·L-1(NH4)2Fe(SO4)2溶液(VO+2H++Fe2+=VO2++Fe3++H2O)最后用c2mol·L-1KMnO4溶液滴定过量的(NH4)2Fe(SO4)2至终点,消耗KMnO4溶液的体积为b2mL。已知MnO
被还原为Mn2+ , 假设杂质不参与反应。则产品中V2O5的质量分数是。(V2O5的摩尔质量:182g•mol-1)
实验1:
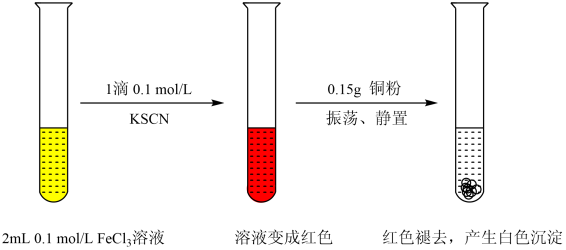
资料:ⅰ.CuSCN、CuCl均为难溶于水的白色固体;均能与硝酸反应,分别生成Cu2+与SO、Cu2+与Cl-。
ⅱ.(SCN)2性质与卤素单质相似,其水溶液呈黄色。

由实验2可知,实验1中白色沉淀的成分是。
|
步骤 |
实验操作 |
实验现象 |
|
I |
|
溶液变为蓝色,澄清透明,底部只有少量红色固体剩余 |
|
II |
取I中上层清液于试管中,滴加1滴0.1mol/L KSCN溶液 |
立刻出现红色,同时有白色沉淀生成 |
|
III |
振荡II中试管,静置 |
白色沉淀变多,红色逐渐褪去 |
①步骤I的实验操作是。
②根据实验3的现象,小组同学认为Fe3+与Cu反应的氧化产物不含Cu(I),他们的判断依据是。
③步骤Ⅱ中加入KSCN溶液后出现红色的可能原因是。
④解释步骤III中实验现象产生的可能原因:。