族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | |||||
按要求回答下列问题:
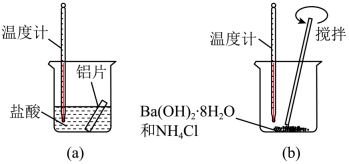
①在实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是热反应,(b)中温度降低,由此可以判断(b)中反应是热反应。
②写出铝与盐酸反应的离子方程式:。
③根据能量守恒定律,(b)中反应物的总能量应该(填“高于”或“低于”)其生成物的总能量。

①化学键断裂需要(填“释放”或“吸收”)能量。
②图中共释放的能量为kJ。
③该反应的反应物的总能量(填“大于”、“等于”或“小于”)生成物的总能量,所以该反应是反应。
a. b.容器内压强保持不变
c. d.容器内混合气体的密度保持不变
a.降低温度 b.加入催化剂 c.增大容器体积

a.甲、乙均为化学能转变为电能的装置
b.甲中锌片是负极,乙中铜片是正极
c.甲、乙溶液中的pH均增大
d.若将稀硫酸换为硫酸铜溶液,则甲、乙中铜片的质量均增加
a.甲中铜片换成锌片
b.乙中锌片和铜片相互倾斜至上端接触
c.甲中稀硫酸用乙醇代替


