| 装置 | 实验 | 试剂a | 现象与结果 |
| | I | 10h后,液体变为浅蓝色,将铜片取出、干燥,铜表面附着蓝色固体,成分是Cu(OH)2 | |
| II | 8mL5mol/L氨水 | 立即产生大量气泡,溶液变为深蓝色,将铜片取出、干燥,铜表面附着蓝色固体,成分是Cu(OH)2 | |
| III | 8mL5mol/L氨水和1gNH4Cl固体 | 立即产生大量气泡,溶液变为深蓝色,将铜片取出、干燥,铜片依然保持光亮 |
下列说法错误的是( )

①  (g)
(g)
 (g)+H2O(g) ΔH1=+28kJ/mol K1(190℃)=104
(g)+H2O(g) ΔH1=+28kJ/mol K1(190℃)=104
②2 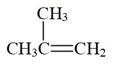 (g)
(g)
 (g)(二聚异丁烯) ΔH2=-72kJ/mol K2(190℃)=0.1
(g)(二聚异丁烯) ΔH2=-72kJ/mol K2(190℃)=0.1
下列说法错误的是( )

①S2O 中S-O-O(填“是”或“不是”)在一条直线上。
②S2O 中的O-O比H2O2中的更(填“难”或“易”)断裂。

①图中“●”代表的是(填“Mn”或“O”)。
②NA为阿伏加德罗常数,该晶体的密度为g·cm-3。
③MnO2作催化剂,氨催化还原脱除NO的一种催化机理示意图如图。

从化学键的角度解释MnO2能结合NH3的原因:。该催化过程的总反应的化学方程式是。
用K2CO3溶液吸收H2S。
已知:氢硫酸和碳酸的电离常数如表。
|
Ka1 |
Ka2 |
|
|
H2S |
1.1×10-7 |
1.3×10-13 |
|
H2CO3 |
4.5×10-7 |
4.7×10-11 |
①用化学用语表示K2CO3溶液显碱性的原因:。
②用过量的K2CO3溶液吸收H2S的离子方程式是。
在密闭容器中发生反应2H2S(g) S2(?)+2H2(g)。其他条件不变时,H2S的平衡转化率随温度和压强的变化如图。

①P3>P2>P1 , 反应中S2(填‘“是”或“不是”)气态,理由是。
②实际反应在高温下进行的原因是。
间接电解法脱硫过程的示意图如图。

①溶液X的主要溶质是。
②简述在电解反应器中FeCl3溶液再生的原理:。
③不考虑其他副反应,理论上5molH2S反应能生成gH2。

已知:i.  →
→  +H2O
+H2O
ii.—CHO+ 
 +H2O
+H2O
iii.R1—CH=CH—R2 +R1COOH+R2COOH
a.可以用酸性KMnO4溶液鉴别E和G
b.G可以发生加聚反应、还原反应和取代反应
c.1molP最多可以和5molH2反应

①R的结构简式是。
②R→P的化学反应类型是。
|
变化曲线 |
实验现象 |
|
| i.A→B产生红褐色沉淀 ii.B→C红褐色沉淀的量增多 iii.C→D红褐色沉淀的量增多 iv.D点附近产生有刺激性气味的气体 v.D→E红褐色沉淀的量略有增多 |
资料:i.饱和NaClO溶液的pH约为11
ii.Ksp[Fe(OH)3]=2.8×10-39

①M点溶液含氯的微粒有。
②C点附近生成红褐色沉淀的主要反应的离子方程式是。
资料:i.Ksp[Co(OH)2]=5.9×10-15 , Ksp[Co(OH)3]=1.6×10-44
ii.Co2++6NH3 [Co(NH3)6]2+K1=1.3×105
Co3++6NH3 [Co(NH3)6]3+K2=2×1035
iii.[Co(NH3)6]2+和[Co(NH3)6]3+在酸性条件下均能生成NH
实验I.粉红色的CoCl2溶液或CoSO4溶液在空气中久置,无明显变化。
实验II.向0.1mol/LCoCl2溶液中滴入2滴酸性KMnO4溶液,无明显变化。
实验III.按如图装置进行实验,观察到电压表指针偏转。

①甲同学根据实验III得出结论:Co2+可以被酸性KMnO4溶液氧化。
乙同学补充实验IV,(补全实验操作及现象),否定了该观点。
②探究碱性条件下 的还原性,进行实验。

ii中反应的化学方程式是。
③根据氧化还原反应规律解释:还原性Co(OH)2>Co2+:Co2+-e-=Co3+在碱性条件下,OH-与Co2+、Co3+反应,使c(Co2+)和c(Co3+)均降低,但降低的程度更大,还原剂的还原性增强。
①根据实验III和IV推测氧化性:Co3+>Cl2 , 设计实验证明:向V中得到的棕褐色沉淀中,(补全实验操作及现象),反应的离子方程式是。
②向V中得到的棕褐色沉淀中滴加H2SO4溶液,加入催化剂,产生无色气泡,该气体是。
①结合数据解释[Co(NH3)6]2+能被氧化为[Co(NH3)6]3+而失活的原因:。
②根据以上实验,设计物质转化流程图实现[Co(NH3)6]2+的再生:。
示例:Co CoCl2
Co(OH)2