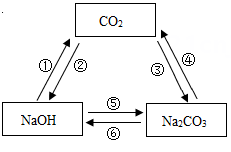
选项 | 事实 | 解释 |
A | 固体碘和碘蒸气都能使淀粉溶液变为蓝色 | 构成物质的原子相同,化学性质相同 |
B | 金刚石的硬度远大于石墨 | 原子排列方式不同 |
C | 水通直流电产生氢气和氧气 | 化学变化中分子是可以再分的 |
D | 炎热的夏天自行车车胎容易爆裂 | 分子间间隔变大 |
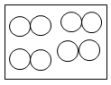 B .
B . 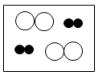 C .
C . 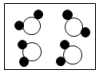 D .
D . 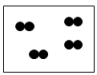
 碳原子结构
C .
碳原子结构
C . 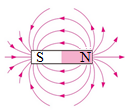 磁场的磁感线
D .
磁场的磁感线
D . 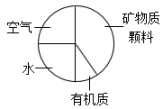 壤土类土壤的组成
壤土类土壤的组成
 B .
B .  C .
C . 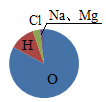 D .
D . 
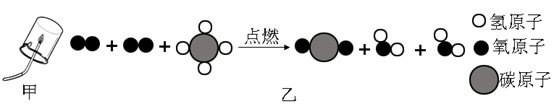

常见物质的溶解度(20° C)
物质名称 | 碳酸氢钠 | 食盐 | 碳酸钠 | 蔗糖 |
溶解度/克 | 9.7 | 36 | 21.5 | 203.9 |

 B . 溶解
B . 溶解  C . 过滤
C . 过滤 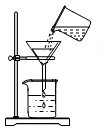 D . 蒸发结晶
D . 蒸发结晶 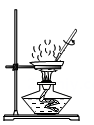
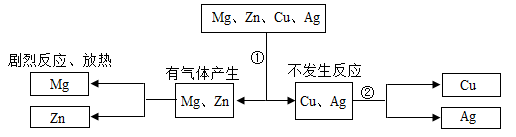
| 药品柜 | 甲 | 乙 | 丙 | 丁 |
| 药品 | 氯化钠 硝酸钾 | 铁丝 镁条 | 稀盐酸 稀硫酸 | 氢氧化钠 氢氧化钙 |
【情景提供】19世纪以前,人们一直以为原子是不可分的,直到1887年,汤姆生发现了带负电的电子后,才引起人们对原子结构模型的探索。
【提出问题】电子带负电,原子不带电,说明原子内存在带正电荷的部分,它们是均匀分布还是集中分布的呢?
【进行实验】1910年英国科学家卢瑟福进行了著名的粒子轰击金箔实验。实验做法如图所示:
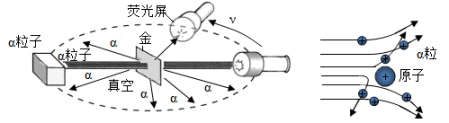
①放射源——放射性物质放出粒子(带正电荷),质量是电子质量的7000倍;
②金箔——作为靶子,厚度1μm,重叠了3000层左右的原子;
③荧光屏——粒子打在上面发出闪光;
④显微镜——通过显微镜观察闪光,且通过360度转动可观察不同角度粒子的到达情况。
【收集证据】绝大多数粒子穿过金箔后仍沿原来的方向前进,但是有少数
粒子却发生了较大的偏转,并且有极少数
粒子的偏转超过90°,有的甚至几乎达到180°,像是被弹了回来。
【猜想与假设】粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生之明显的改变,而结果却出乎意料,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
【解释与结论】
若原子质量、正电荷在原子内均匀分布,则极少数粒子就(填“会”或“不会”)发生大角度散射。卢瑟福所说的“除非原子的大部分质量集中到了一个很小的结构上”中的“很小的结构”指的是。
某研究小组对烧熟的菜中亚硫酸盐含量做了测试,数据如下表:盖有保鲜膜的菜肴在4℃的冰箱中放置不同时间的亚硝酸盐含量(单位:
)
| 菜肴 |
半小时 |
6小时 |
18小时 |
24小时 |
| 炒青菜 |
0.6861 |
0.7982 |
4.3333 |
5.3624 |
| 韭菜炒蛋 |
1.8153 |
1.9249 |
2.8390 |
5.6306 |
| 红烧肉 |
2.4956 |
4.2558 |
4.0668 |
5.5188 |
| 红烧鲫鱼 |
/ |
2.0948 |
3.2300 |
7.2397 |
将一份红烧鲫鱼样本(不盖保鲜膜)在常温下放置4小时,测定其亚硝酸盐含量为8.9483
。
请根据以上材料,回答下列问题:
资料①CH4+4CuO
4Cu+CO2+2H2O;CuO+CO
Cu+CO2②CH4不与碱溶液、浓硫酸发生反应。
小张设计并进行了如图所示的实验:
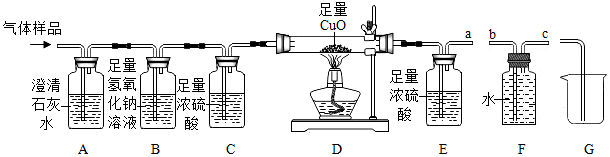
| 装置 |
原来总质量/克 |
完全吸收气体后总质量/克 |
增加的质量/克 |
| 装置E |
115.2 |
118.8 |
|
| 装置F |
111.5 |
115.9 |
已知碳酸氢钠和柠檬酸反应的化学方程式:3NaHCO3+C6H8O7=C6H5O7Na3+3H2O+3CO2↑

|
待测泡腾片 |
量筒内水的体积 |
|
10g甜橙味 |
V1 |
|
10g蓝莓味 |
V2 |
【查阅资料】资料一:Fe粉和Fe3O4粉末能被磁铁吸引而FeO(黑色)不能;
资料二:Fe3O4中铁元素有+2、+3两种化合价,其化学式可用FeFe2O3表示;
【提出猜想】黑色物质可能是Fe3O4、FeO和Fe粉中的一种或几种。
【进行实验】兴趣小组收集了CO与Fe2O3反应生成的黑色物质进行了下列实验:
|
实验方案 |
实验现象 |
|
|
甲 |
取少量黑色物质用磁铁吸引 |
黑色物质全部被磁铁吸引 |
|
乙 |
取少量黑色物质加入 |
30%热的盐酸中 无气泡、溶液颜色变成黄绿色 |
|
丙 |
取少量黑色物质加入硫酸铜溶液中 |
无任何现象 |
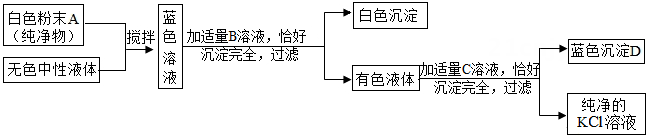
【实验结论】⑴乙、丙实验现象说明黑色物质中没有。
⑵甲实验现象说明黑色物质中没有FeO,因此生成的黑色物质应为F e3O4。
⑶试写出黑色粉末和热的稀盐酸反应的化学方程式:。
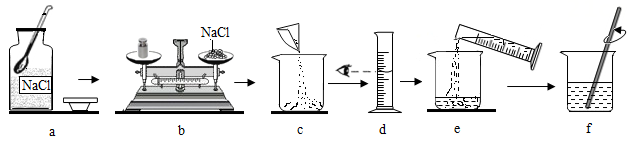
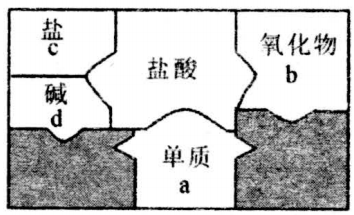
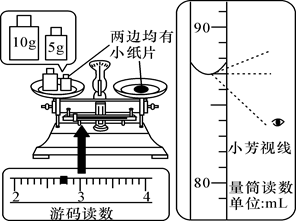
A. b操作中砝码和氯化钠放错盘
B. c操作中烧杯用水洗涤后未干燥就使用
C. d操作中平视量筒凹液面最低处读数
D. e操作中有少量水溅出
| 温度/℃ |
20 |
30 |
40 |
50 |
60 |
80 |
200 |
| 溶解度/g |
21.8 |
39.7 |
48.8 |
47.3 |
46.4 |
45.1 |
44.7 |
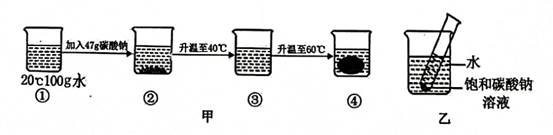
|
用品 |
脱氧剂 |
洁厕灵 |
管道疏通剂 |
|
有效成分 |
还原铁粉 |
盐酸 |
氢氧化钠固体、铝粉 |
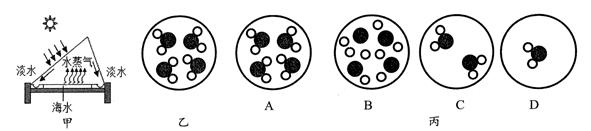
| 温度/℃ | 20 | 30 | 40 | 50 | 60 | 80 | 100 |
| 溶解度/g | 21.8 | 39.7 | 48.8 | 47.3 | 46.4 | 45.1 | 44.7 |
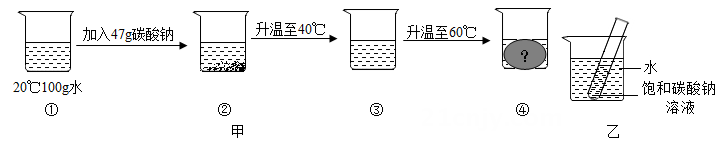
|
温度(℃) |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
|
氯化钠溶解度(克) |
35.8 |
36.0 |
36.3 |
36.4 |
37.0 |
37.3 |
37.8 |
|
硝酸钾溶解度(克) |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
138 |
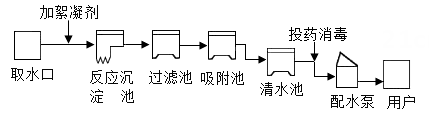
|
实验操作 |
0 |
1 |
2 |
3 |
4 |
5 |
|
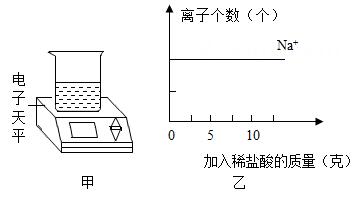
加入稀盐酸的总质量(克) |
0 |
2.5 |
5 |
7.5 |
10 |
12.5 |
|
烧杯和相关物质的总质量(克) |
74.50 |
77.00 |
79.50 |
81.78 |
84.06 |
86.56 |
查阅资料发现:碳酸钠与盐酸发生的化学反应:Na2CO3+2HCl=2NaCl+H2O+CO2↑,实验过程中,若碳酸钠过量时发生的化学反应:Na2CO+HCl=NaHCO3+NaCl,碳酸钠完全反应后继续加入盐酸发生的化学反应:NaHCO3+HCl=NaCl+H2O+CO2↑。
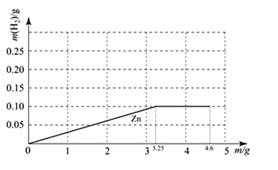
|
氢氧化物 |
Fe(OH)3 |
Mg(OH)2 |
|
开始沉淀的 pH |
1.5 |
8.6 |
|
完全沉淀的 pH |
3.2 |
11.1 |
|
第一次 |
第二次 |
第三次 |
第四次 |
第五次 |
|
|
加入纯碱样品的质量/g |
6 |
6 |
6 |
6 |
6 |
|
电子天平的示数/g |
163.8 |
167.6 |
171.4 |
177.4 |
183.4 |