


①科学家在常温下利用Pt等催化剂在光照下使水分解产生氢气,三种催化剂的催化效果如图1所示。催化效果最好的是(填序号)。
a、Pt催化剂 b、Ni催化剂 c、La催化剂
②CuO和ZnO的混合物可作为合成甲醇的催化剂,催化效果如图2所示。根据图2判断,混合催化剂中CuO的质量分数为%,催化效果最好。在其他条件不变的前提下,催化剂不单独选择CuO或ZnO的原因是。
①SiO2中,硅元素的化合价为。
②下图为氦在元素周期表中的部分信息。

氦-3原子的质子数与中子数之和为3,则其中子数为、核外电子数为。氦-3原子和氦-4原子属于同一种元素,理由是。
气体成分 | CO2 | N2 | Ar | O2 | 其他 |
体积分数% | 95.32 | 2.7 | 1.6 | 0.13 | 0.25 |
①相同条件下,火星大气密度(填“>”、“=”或“<”)空气密度。
②为鉴别一瓶模拟“火星低层大气”组成的气体和一瓶空气,可用来检验。
③若为满足人类未来在火星上生活,下列研究设想合理的是(填序号)。
a、将火星上的N2与O2反应生成水 b、寻找水的存在和开发水循环技术
古人认为,水是一种元素,不可再分。
1766年,英国科学家卡文迪许发现将金属锌加入到硫酸中,会产生一种无色的可燃性气体,他将这种气体叫做“可燃空气”。
同一时期,英国科学家普利斯特里,也在研究这种“可燃空气”,他发现这种气体密度只有空气的1/11,这种气体在玻璃容器燃烧,容器内壁会产生水雾。
1775年,法国科学家拉瓦锡通过实验验证空气是一种混合物,其中氧气约占1/5。
1781年,卡文迪许改进了原来的实验方案,他用纯净的氧气代替空气,发现“可燃空气”在纯氧中可以安静燃烧,生成物只有水,没有别的物质。
1782年,拉瓦锡将水蒸气通过高温金属铁管,获得了“可燃空气”和一种黑色固体由此他认为水不是一种元素,而是由“可燃空气”和氧结合形成的化合物。
1787年,拉瓦锡命名这种“可燃空气”为“氢气”,正式提出“氢”是一种元素。
1800年,英国科学家尼克尔森和卡里斯特尔用“伏打电池”在常温下进行了水的电解实验,获得成功,进一步证明了拉瓦锡的结论。
依据文章内容回答下列问题。
a、普利斯特里气体燃烧实验 b、1781年卡文迪许实验
c、1782年拉瓦锡实验 d、1800年尼克尔森和卡里斯特尔实验
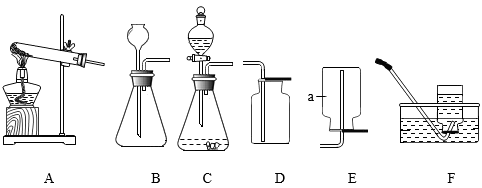
a、10mL b、20mL c、30mL d、40mL
资料1:FeSO4的溶解度如下表:
温度℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
溶解度/g | 15.6 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 | 59.8 |
资料2:FeSO4易被氧气氧化,转化为Fe2(SO4)3。
资料3:草酸(H2C2O4)溶液与FeSO4溶液发生反应:
【制备流程】

在实验室进行“过滤”操作时,用到的玻璃仪器有、和玻璃棒,玻璃棒的作用是。
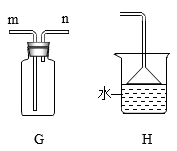
FeC2O4·nH2O加热至300℃完全失去结晶水,继续加热至400℃,剩余固体又变成黑色,同时生成气体。为确定分解产物及n的值,设计了下图所示实验。实验时先打开弹簧夹a、b,鼓入一段时间氮气,然后关闭a,加热热分解装置。
资料1:无水硫酸铜是白色固体,遇水变蓝;浓硫酸具有吸水性。
资料2:FeO是一种黑色固体,在空气中不稳定,易被氧化。
【实验设计】

【实验分析】
实验过程中观察到:A中白色固体变蓝,证明产物有:B中石灰水变浑浊,证明产物有CO2;D中(填实验现象),证明产物有CO。

①FeC2O4·nH2O中n的值为(写出计算过程)。
②若草酸亚铁晶体中混有杂质(杂质不参加反应),会导致测得的的值(填“偏大”、“不变”或“偏小”)。
③B点物质的化学式为。
④将B点物质在空气中继续加热至500℃得到C点物质,BC段发生反应的化学反应方程式为。