化学键 | H-H | Cl-Cl | H-Cl |
断开1mol化学键需要的能量/kJ | 436 | 243 | 431 |


①由图象分析,化学反应速率最快的是(填字母)段。
②为了增大上述反应的速率,下列操作可行的是(填字母)。
a.加蒸馏水 b.加氯化钠溶液 c.加浓盐酸 d.加热
编号 | a | b | c | d |
电池装置 |
|
|
|
|
①上述四种电池中,属于二次电池的是(填字母,下同),属于干电池的是。
②a装置中,外电路中电子的流向是(填“从Zn流向Cu”或“从Cu流向Zn”)。
③c装置中,若将电解质改为碱性介质,则负极的电极反应式为。
①该电池的电解质溶液可以是。
②当外电路中转移1mol电子时,电解质溶液的质量增加g。
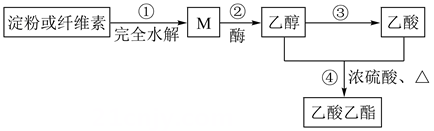
a.淀粉和纤维素的分子式均为(C6H10O5)n , 但n值不同
b.反应③的类型为加成反应
c.M可与银氨溶液在碱性、加热条件下反应析出银
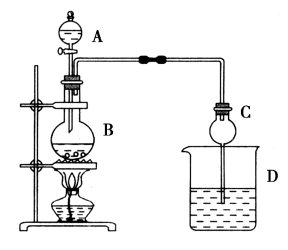
已知:①氯化钙可与乙醇形成微溶于水的;
②;
③有关有机物的沸点如下表:
|
试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
|
沸点/℃ |
34.7 |
78.8 |
118 |
77.1 |
加热一段时间,B中生成乙酸乙酯的化学反应方程式为。
a.五氧化二磷 b.碱石灰 c.无水硫酸钠 d.生石灰

①试管a中发生反应的化学方程式为,该反应可用于制备漂白液。
②试管b中的现象为,说明非金属性:Q(填“>”、“<”或“=”)I。
a.元素Ga位于周期表的第4周期IIIA族
b.一定条件下,Ga既能溶于稀盐酸又能溶于氢氧化钠溶液
c.离子半径:
d.常温下,Ga可与水剧烈反应放出氢气