FeCl3是棕红色固体,易潮解,在300℃以上可升华成含二聚三氯化铁( ![]() )分子的气体。可用于金属刻蚀,污水处理等。主要有以下制备方法:
)分子的气体。可用于金属刻蚀,污水处理等。主要有以下制备方法:
方法①:氯化法。以废铁屑和氯气为原料,在立式反应炉里反应,生成的氯化铁蒸气和尾气由炉的顶部排出,进入捕集器冷凝为固体结晶。
方法②:熔融法。将铁屑和干燥氯气在低共熔混合物(如30%KCl与70%FeCl3混合)内进行反应生成氯化铁,升华后收集在冷凝室中,该法制得的氯化铁纯度高。
方法③:复分解法。用氧化铁与盐酸反应后得到氯化铁溶液。
方法④:氯化亚铁合成法。将铁屑溶于盐酸中,然后向其中通入氯气得到氯化铁。

含硫矿物如黄铁矿(FeS2)、黄铜矿、芒硝在工业上有着重要的用途。收集黄铜矿炼铜过程中产生的SO2制备SO3 , 其反应为2SO2(g)+O2(g) 2SO3(g)


交换膜
历程ⅰ:
历程ⅱ:
历程ⅲ:
历程ⅳ:
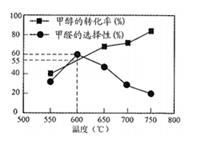
如图所示为在体积2L的恒容容器中,投入1molCH3OH,在碳酸钠催化剂作用下,经过
5min反应,测得甲醇转化率与甲醛的选择性与温度的关系(甲醛的选择性:转化的CH3OH中生成HCHO的百分比),下列有关说法正确的是( )

已知:①钒元素的存在形态较多,部分四价钒和五价钒物种的分布分数与pH的关系如图-1所示。
②Fe(OH)2完全沉淀的pH为8.4;VO(OH)2完全溶解的pH约为11
③吉布斯自由能( G)可以用来判断反应进行的方向。一个反应的
G越小,反应发生的可能性越大。

②若“浸出”时浸出剂中添加NaOH固体,并边浸出边通入CO2 , 可大大提高钒的浸出率,
原因是。

已知:①Na2CO3+2Na2S+4SO2=3Na2S2O3+CO2
②Na2SO4溶解度如图-2所示。
步骤1.准确称取8.00g样品,溶于水,.加入5mL甲醛,配成100mL溶液。
步骤2.准确称取0.294gK2Cr2O7于碘量瓶中,加入20mL蒸德水溶解,再加入5mL H2SO4和20mL10%KI溶液使铭元素完全转化为Cr3+ , 加水稀释至100mL。
步骤3.向碘量瓶中加入1mLl%淀粉,用待测Na2S2O3溶液滴定碘量瓶中溶液至滴定终点,消耗Na2S2O3溶液20.00mL。(已知: )
①写出“步骤2”中反应的离子方程式。
②试计算 的纯度(写出计算过程)
CH4(g)+H2O(g)=CO(g)+3H2(g) △H1=+206.2 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) △H2=-41.1 kJ·mol-1
CH4(g)=C(g)+2H2(g) △H3=+74.8 kJ·mol-1
①反应C(g)+2H2O(g)=CO2(g)+2H2(g) △H4= kJ·mol-1
②向原料中添加正硅酸锂Li4SiO4作为CO2的吸附剂,除产生氢气外还生成两种盐,写出该反应的方程式。
