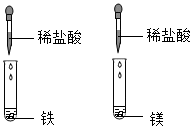
 B .
B . 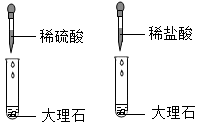 C .
C . 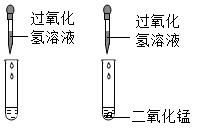 D .
D . 
①取该样品溶于水,得到无色溶液;
②取适量上述溶液加过量的BaCl2溶液,出现白色沉淀,过滤;
③向步骤②所得沉淀中加入过量的稀HNO3 , 沉淀部分消失并产生气泡;
④取步骤②的溶液加入AgNO3溶液生成白色沉淀,再加入稀HNO3振荡,沉淀不消失。下列说法正确的是( )
Ⅱ.将适量B分别滴入少量的A、C、D、E中,C中有气泡出现,其余均没有明显现象;
Ⅲ.将适量D分别滴入少量的A、B、C、E中,均没有明显现象.
①已知:K2SO4与BaCl2反应的化学方程式为:K2SO4+BaCl2=2KCl+BaSO4↓
②把易溶于水、易离解的物质写成离子形式,把难溶的物质、气体和水等仍用化学式表示.上述方程式可改写成:2K++SO42-+Ba2++2Cl-=BaSO4↓+2K++2Cl- ③删去方程式两边不参加反应的离子:Ba2++SO42-=BaSO4↓
④检查方程式两边各元素的原子个数和电荷总数是否相等。请回答:

实验原理:测定下图C装置中生成的BaCO3沉淀的质量,通过计算确定牙膏中CaCO3的质量分数。
查阅资料:①CO2+Ba(OH)2=BaCO3↓+H2O,牙膏中其他成分遇到盐酸时无气体产生;
②饱和碳酸氢钠可以吸收HCl气体,且发生反应的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2;
③CO2不会溶于饱和碳酸氢钠溶液。实验装置如下图根据探究过程回答下列问题:


(提出问题)滤液中溶质的成分是什么?
(假设与猜想)猜想一:NaCl猜想二:NaCl和CaCl2猜想三:NaCl、Ca(OH)2和HCl猜想四:。
(讨论与交流)经讨论同学们一致认为猜想是错误的。
(实验与结论)
|
实验步骤 |
实验现象 |
实验结论 |
|
取少量滤液于试管中,滴加适量碳酸钠溶液 |
无现象 |
猜想四成立 |
|
取少量滤液于试管中,滴加适量 |
|
猜想三:。
【实验探究】
|
实验步骤 |
实验现象 |
实验结论 |
|
⑴用小试管取少量固体样品加水完全溶解,再滴加过量BaCl2溶液 |
产生白色沉淀 |
猜想不正确 |
|
⑵取(1)中的少量上层清液于试管中,滴加酚酞溶液 |
|
猜想二正确,猜想三不正确 |
②另一同学认为上述实验步骤可以先滴酚酞,再加过量BaCl2溶液,也可以得到正确结论。你是否同意(?
|
实验序号 |
实验方法与操作 |
实验现象 |
|
① |
将少许Cu(OH)2粉末加到5mL蒸馏水中,充分振荡 |
沉淀不消失 |
|
② |
|
1号试管蓝色固体不消失 |
|
2号试管蓝色固体不消失 |
||
|
3号试管蓝色固体减少 |
||
|
4号试管蓝色固体消失,溶液呈亮蓝色 |

【问题】滤液中可能含有哪些溶质?
【猜想】猜想一:溶质为NaCl; 猜想二:溶质为NaCl和BaCl2;
猜想三:溶质为NaCl、BaCl2、HCl; 猜想四:溶质为。
【分析】根据已学知识,可判断猜想三是不合理的,理由是。
|
实验过程 |
实验现象 |
实验结论 |
|
|
有气泡产生 |
你的猜想是正确的 |
【实验】接着他们取部分滤液于试管中,向其中滴加少量的Na2SO4溶液,观察到无明显现象,为验证猜想,他们进一步实验,实验设计如表,请你帮他们补充完整。
【交流】通过上述实验我们能够总结出在确定化学反应后所得溶液中溶质成分时,除了考虑生成物外,还需要考虑?
实验一:探究碳酸氢钠的化学性质

⑴取样品溶于适量的水中,测得溶液的pH大于7。
⑵向小苏打样品中滴加盐酸,有大量气泡产生,经检验该气体是二氧化碳,该反应的化学方程式为。
⑶向小苏打的溶液中加入澄清石灰水,生成了白色沉淀。
⑷同学们通过查阅资料,在老师的指导下采用了如上图所示装置对小苏打和纯碱做了对比实验.实验中小试管内沾有无水硫酸铜粉末的棉花球变成蓝色,a烧杯中石灰水无明显现象,b烧杯中石灰水了现白色浑浊.试回答:
①在实验结束时,操作上要注意的问题是:。
②由实验(4)可以得出的结论是。
③请归纳出小苏打的化学性质(至少三点)、、。
|
测量次数 |
第1次 |
第6次 |
第16次 |
第21次 |
第26次 |
|
滴加的稀盐酸总质量/g |
0 |
5 |
15 |
20 |
25 |
|
溶液总质量/g |
50 |
55 |
m |
69.78 |
74.78 |
|
溶液pH |
12.4 |
12.1 |
7.0 |
2.2 |
2.1 |
请分析计算:

a.碱石灰的脱硫效率比石灰石的要高
b.将时间由300s变成400s,能提高碱石灰的脱硫效率
c.将原煤和脱硫剂粉碎、混合均匀,能提高脱硫效率
d.燃煤烟气中二氧化硫的浓度对脱硫速率没有影响
已知:①氢氧化钠与二氧化硫反应转化为Na2SO3 , 氧化钙与二氧化硫反应转化为CaSO3。②假设二氧化硫全部被吸收