已知C+CO2 2CO,2CO+O2
2CO2
| 物质 | 丙醇 | 氧气 | 水 | 二氧化碳 | X |
| 反应前质量/g | 6.0 | 12.8 | 0 | 0 | 0 |
| 反应后质量/g | 0 | 0 | 7.2 | 8.8 | a |
下列判断正确的是 ( )


4FeSO4+O2+2H2SO4 2 Fe2(SO4)3+2H2O
①硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍,该菌的作用是。
②整个过程中,要除去340千克H2S,理论上需消耗O2千克。
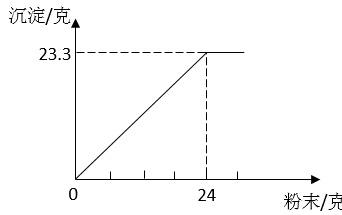
①若该硫酸的质量为1.2a克,加入粉末的质量为30克时,产生沉淀质量为克。
②若粉末的质量为x克,该硫酸的质量为2a克,产生的沉淀的质量为y克。试写出粉末质量x克与产生沉淀质量y克之间的关系。
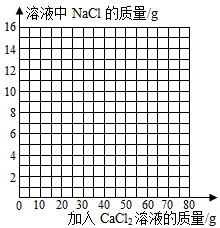
|
实验序号 |
1 |
2 |
3 |
4 |
5 |
|
加入CaCl2溶液质量/克 |
15 |
15 |
15 |
15 |
15 |
|
生成沉淀的总质量/克 |
3 |
m |
9 |
10 |
10 |
求:
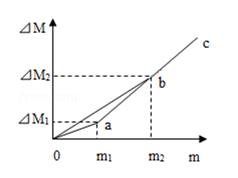
①从向左右烧杯加入金属开始观察,当左右烧杯加入的金属粉末质量相同且观察到反应不再进行后停止观察,则指针变化情况为;
②m1:m2=,曲线oac表示的是(选填“左边”或“右边”)烧杯中△M与m的变化关系
取10克生石灰 粉末A质量为12克
气体B
沉淀质量为2.5克
|
项目 |
平均油耗/L |
co排放量/g |
|
乙醇汽油 |
11.8 |
1.358 |
|
普通汽油 |
11.8 |
2.108 |


| 加入稀盐酸次数 | 0 | 1 | 2 | 3 | 4 |
| 烧杯和所称物质总质量/克 | 150 | 198.9 | 247.8 | 297.8 | m |
A.水会蒸发 B.盐酸会挥发 C.钙片没有充分研磨

已知:石灰石样品中杂质不参与反应。
可能用到的化学方程式:
CaO+H2O=Ca(OH)2
Ca(OH)2+2HCl=CaCI2+2H2O

|
序号 |
加入稀盐酸的质量/g |
剩余固体的质量/g |
|
第1次 |
20 |
15 |
|
第2次 |
20 |
10 |
|
第3次 |
20 |
6.6 |
|
第4次 |
20 |
n |
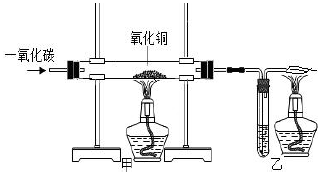
|
反应前 |
氧化铜完全反应后 |
|
|
I组 |
洗气瓶和石灰水的质量为185g |
洗气瓶和瓶内物质的总质量为187g |
|
II组 |
玻璃管和氧化铜样品的质量为57. 9g |
玻璃管和玻璃管内物质的质量为56. 1g |

他想测定此味精中NaCl含量是否符合其包装上标注的标准.
【查阅资料】NaCl+AgNO3=AgCl↓+NaNO3;谷氨酸钠存在不影响NaCl性质.
【实验过程】①称取该味精样品5.0g,并溶于蒸馏水;②加入过量的硝酸银溶液;③过滤;④用蒸馏水反复洗涤沉淀多次;⑤将沉淀烘干、称量,测得固体质量为2.87g.
【回答问题】
【实验一】将100g大理石样品放入硬质玻璃管中高温加热,在不同反应时间测得的实验数据如下表(大理石高温加热的反应方程式是:CaCO3 CaO+CO2↑,杂质不反应):
|
反应时间/min |
0 |
5 |
9 |
12 |
15 |
|
剩余固体质量/g |
100 |
91.2 |
73.6 |
64.8 |
64.8 |
【实验二】将100g大理石样品放入一定量的稀盐酸中,充分反应后测得实验数据如如图(杂质不与稀盐酸反应,气体的溶解忽略不计):
根据实验及有关数据进行分析:
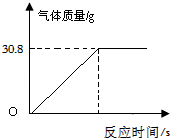
【实验小组根据实验二】数据计算出样品中杂质的质量为30g.经检查无计算原理及数字运算错误.请判断【实验二】的测定结果是否正确,如不正确要指出错误的原因.
实验室购买了一批双氧水(H2O2)溶液,某兴趣小组的同学要测定其质量分数,他们设计了如图所示的装置,其实验的操作步骤如下:

①组装仪器,并检查气密性;
②在A、B、C三个仪器中装入药品,其中双氧水溶液质量为50g;
③用电子秤称量出整套装置的总质量为498.6g;
④关闭a处止水夹,打开A仪器的阀门,向锥形瓶中加入全部的双氧水溶液,随即关闭A仪器的阀门;
⑤充分反应后,打开a处止水夹,向装置中持续缓慢地鼓入X气体。
⑥第二次称量整套装置的总质量为497g;