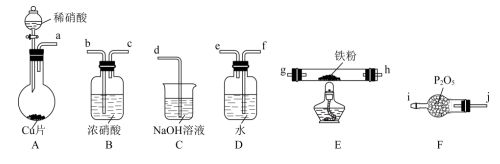
已知:①浓硝酸可将NO氧化为NO2;②NaOH溶液能与NO2反应,不与NO反应。
打开A装置分液漏斗活塞,烧瓶中观察到的实验现象有:铜片表面出现无色气泡,铜片逐渐变小、、烧瓶中溶液由无色变为蓝色。
假设①NO2氧化Na2O2;假设②Na2O2氧化NO2
甲同学设计如图所示实验装置:
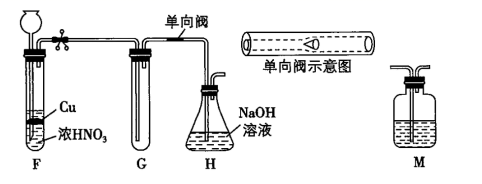
请回答下列问题:
甲乙两同学对假设分别进行了验证:
| 实验操作 | 现象 | 结论 | |
| 甲同学 | 待试管G中收集满气体,向其中加入适量Na2O2粉末,塞紧塞子,轻轻振荡试管,观察现象;并将带火星的木条迅速伸进试管,观察。 | 红棕色气体迅速消失;木条复燃 | 假设①正确 |
| 乙同学 | 在F、G之间增加一个M洗气瓶,目的是,重复甲同学的实验操作。 | 红棕色气体迅速消失,带火星的木条未复燃 | 假设②正确 |
请做出正确判断,写出NO2和Na2O2反应的化学方程式。

|
反应温度/℃ |
60 |
70 |
80 |
90 |
|
钴的浸出率/% |
88 |
90.5 |
93 |
91 |
|
共价键 |
H-H |
I-I |
H-I |
|
键能/kJ·mol−1 |
436 |
151 |
299 |
则该反应的ΔH=kJ·mol−1。
②下列叙述能说明上述反应已达到平衡的是。
a.单位时间内生成nmolH2 , 同时生成nmolHI
b.温度和体积一定时,HI浓度不再变化
c.温度和体积一定时,混合气体颜色不再变化
d.温度和压强一定时,混合气体的密度不再变化
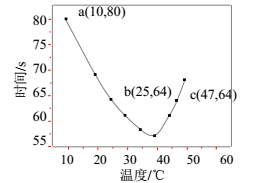
图中a点对应的NaHSO3反应速率为mol·L-1·s-1。b、c两点对应的NaHSO3反应速率v(b)v(c)(填“>”、“=”、“<”)。
NH4I(s)=NH3(g)+HI(g)①
2NH3(g)=N2(g)+3H2(g)②
2HI(g)=I2(g)+H2(g)③
达平衡时,体系中n(HI)=bmol,n(I2)=cmol,n(H2)=dmol,则n(N2)=mol,t℃时反应①的平衡常数K值为 (用字母表示)。
A.配位键 B.金属键 C.离子键 D.共价键 E.氢键 F.范德华力

 已知:苯环上有羧基时,新引入的取代基连在苯环的间位。
已知:苯环上有羧基时,新引入的取代基连在苯环的间位。
请回答下列问题:
①红外光谱检测分子中含有醛基;
②1H-NMR谱显示分子中含有苯环,且苯环上有两种不同化学环境的氢原子。