①“铝热反应”属于四种基本反应类型中的反应。
②信息中的“某些”指(填“比铝活泼”“比铝不活泼”或“任意”)。
③试写出铝粉与MnO2发生的铝热反应方程式:。

①步骤I中发生反应的离子方程式为。
②步骤II用热空气吹出的Br2被纯碱溶液吸收时,则被氧化和被还原的Br2的物质的量之比为。
![]()
①若操作I用H2O2溶液(稀硫酸酸化)完成碘元素的转化,则反应的离子方程为。
②操作II的名称为、,此过程中可以选用的有机溶剂是(填一种)。

请回答下列问题:

①加入浓H2SO4的作用是催化剂、。
②实验中球形干燥管除起冷凝作用外,另一个重要作用是。
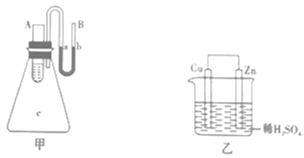
①Zn为正极,Cu为负极;
②H+向负极移动;
③电子的流动方向,从Zn经外电路流向Cu;
④Cu极上有H2产生;
⑤若有1mol电子流过导线,则产生H2为0.5mol;
⑥正极的电极反应式为Zn-2e-=Zn2+。
以上描述合理的是(填序号)。
①若图乙的烧杯中最初装入的是500mL2mol·L-1的稀硫酸,当原电池工作2min时共收集到11.2L氢气(标准状况),则这2min内H2SO4的反应速率v(H2SO4)=。2min末,烧杯内溶液中溶质的物质的量浓度分别为(溶液体积变化忽略不计)c(H2SO4)=、c(ZnSO4)=。
②若要使反应Zn+H2SO4=ZnSO4+H2↑的速率加快,下列措施可行的是(填序号)。
a.改锌片为锌粉
b.改稀H2SO4为98%的浓硫酸
c.升高温度
d.滴加少量CuSO4溶液