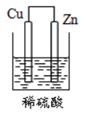
 B .
B . 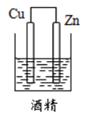 C .
C .  D .
D . 
|
ⅠA |
ⅧA |
|||||||
|
1 |
① |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
|
|
2 |
② |
③ |
④ |
⑧ |
||||
|
3 |
⑤ |
⑥ |
⑦ |
⑨ |
请按要求回答下列问题。