
选项 | 实验目的 | 实验方案 |
A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热.冷却后,取出上层水溶液,用稀HNO3酸化,加入AgNO3溶液,观察是否产生淡黄色沉淀 |
B | 检验Fe(NO3)2晶体是否已氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液,观察溶液是否变红 |
C | 验证Br2的氧化性强于I2 | 将少量溴水加入KI溶液中,再加入CCl4 , 振荡,静置.可观察到下层液体呈紫色 |
D | 验证Fe(OH)3的溶解度小于Mg(OH)2 | 将FeCl3溶液加入Mg(OH)2悬浊液中,振荡,可观察到沉淀由白色变为红褐色 |
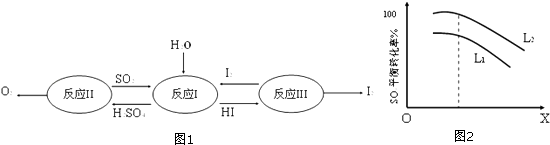
完成下列填空
反应Ⅰ得到的产物用I2进行分离.该产物的溶液在过量I2的存在下会分成两层﹣﹣含低浓度I2的H2SO4层和高浓度的I2的HI层.
a.两层溶液的密度存在差异
b.加I2前,H2SO4溶液和HI溶液不互溶
c.I2在HI溶液中比在H2SO4溶液中易溶
反应Ⅱ:2H2SO4(l)→2SO2(g)+O2(g)+2H2O(g)﹣1100kJ 它由两步反应组成:
i.H2SO4(l)→SO3(g)+H2O(g)﹣177kJ ii.SO3(g)分解.
L(L1、L2),X可分别代表压强或温度.图2表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系.
完成下列填空

a.碱石灰 b.无水氯化钙 c.五氧化二磷 d.生石灰
已知:①SO2(g)+Cl2(g)⇌SO2Cl2(l)+Q(Q>0)
②硫酰氯常温下为无色液体,熔点为﹣54.1℃,沸点为69.1℃,在潮湿空气中“发烟”;
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氯气.


已知:

a.能发生取代反应 b.能与浓溴水反应c.能发生消去反应 d.能与H2发生加成反应
①能发生银镜反应 ②能与NaHCO3溶液反应
③分子中有四种化学环境不同的氢原子 ④苯环上只有2个取代基,无 ![]() 结构
结构
写出其中任一种与足量NaOH溶液共热反应的化学方程式:.
①3FeS2+8O2→Fe3O4+6SO2 ②4FeS2+11O2→2Fe2O3+8SO2