元素 | 元素性质或原子结构 |
X | 原子的最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 基态原子最外层电子排布式为(n+1)sn(n+1)pn+2 |
T | 与Z同周期,元素最高价是+7价 |
W | 原子序数为Y、T元素之和,不锈钢中含有该元素 |
A.常温下Z的单质和T的单质状态不同
B.T的氢化物比Z的氢化物稳定
C.一定条件下Z和T的单质都能与氢氧化钠溶液反应
D.T的电负性比Z大
②上述反应至无气泡逸出后,取适量残留溶液,插入pH传感器并逐滴滴入碳酸钠溶液,测得pH变化曲线如图所示

请用离子方程式表示BC段、CD段发生的反应:
BC段:;
CD段:.

CaSO4(s)+CO(g)⇌CaO(s)+SO2(g)+CO2(g)△H1=218.4kJ•mol﹣1(反应Ⅰ)
CaSO4(s)+4CO(g)⇌CaS(s)+4CO2(g)△H2=﹣175.6kJ•mol﹣1(反应Ⅱ)
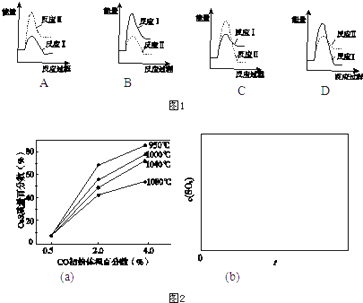
请回答下列问题:

(注:SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃)