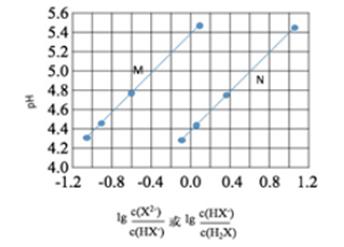
 C . 硫化钠的电子式:
C . 硫化钠的电子式: 第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至 230 ℃制得高纯镍。下列判断正确的是( )
双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:
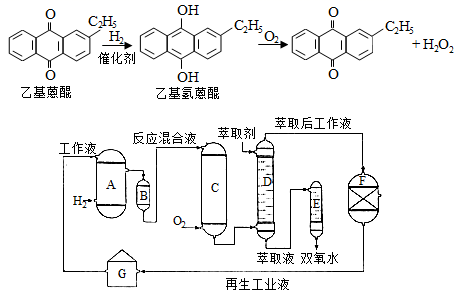
A.氢化釜 B.过滤器 C.氧化塔 D.萃取塔 E.净化塔 F.工作液再生装置 G.工作液配制装置
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定的温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题:
①C4H10(g)= C4H8(g)+H2(g) ΔH1
已知:②C4H10(g)+ O2(g)= C4H8(g)+H2O(g) ΔH2=-119 kJ·mol-1
③H2(g)+ O2(g)= H2O(g) ΔH3=-242 kJ·mol-1
反应①的ΔH1为 kJ·mol-1。图(a)是反应①平衡转化率与反应温度及压强的关系图,x0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是(填标号)。

A.升高温度 B.降低温度 C.增大压强 D.降低压强
①从结构角度分析,R中两种阳离子的相同之处为,不同之处为。(填标号)
A.中心原子的杂化轨道类型 B.中心原子的价层电子对数
C.立体结构 D.共价键类型
②R中阴离子N5-中的σ键总数为个。分子中的大π键可用符号 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
),则N5-中的大π键应表示为。
③图(b)中虚线代表氢键,其表示式为(NH4+)N-H┄Cl、、。

溶解度/(g/100g水)
|
0 |
20 |
40 |
60 |
80 |
100 |
|
|
NH4Cl |
29.3 |
37.2 |
45.8 |
55.3 |
65.6 |
77.3 |
|
ZnCl2 |
343 |
395 |
452 |
488 |
541 |
614 |
溶度积常数
|
化合物 |
Zn(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
|
Ksp近似值 |
10-17 |
10-17 |
10-39 |
回答下列问题: