|
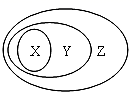
| X | Y | Z |
| A | 碱 | 电解质 | 化合物 |
| B | 离子反应 | 置换反应 | 氧化还原反应 |
| C | 胶体 | 分散系 | 混合物 |
| D | 碱性氧化物 | 金属氧化物 | 氧化物 |

①取一定量的样品,加足量水充分溶解,过滤得到滤液和滤渣;
②取少量滤液,加入BaCl2溶液,有白色沉淀产生;
③取少量滤渣,加入稀盐酸,滤渣全部溶解,同时有气体产生。
根据上述实验现象,该固体样品的成分可能是( )
①MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O。根据以上两个反应,回答下列有关问题:
A.还原性B.氧化性C.酸性
若有17.4gMnO2参与反应,则被氧化的HCl的质量为g。