 B .
B . 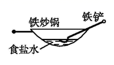 C .
C . 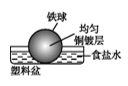 D .
D . 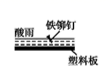
负极:Fe(s)+ 2HCO3- (aq) -2e- = FeCO3 (s)+H2CO3(aq)(主要)
正极:2H2CO3(aq) +2e- = H2↑+2HCO3- ( aq)(主要)
下列说法错误的是( )
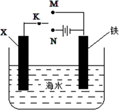

 B .
B . 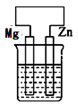 C .
C .  D .
D . 
资料显示:原电池装置中,负极反应物的还原性越强,或正极反应物的氧化性越强,原电池的电压越大。
|
装置 |
编号 |
电极A |
溶液B |
操作及现象 |
|
| Ⅰ | Fe | pH=2的H2SO4 | 连接装置后,石墨表面产生无色气泡;电压表指针偏转 |
| Ⅱ | Cu | pH=2的H2SO4 | 连接装置后,石墨表面无明显现象;电压表指针偏转,记录读数为a |
① 同学们认为实验Ⅰ中铁主要发生了析氢腐蚀,其正极反应式是。
② 针对实验Ⅱ现象:甲同学认为不可能发生析氢腐蚀,其判断依据是;乙同学认为实验Ⅱ中应发生吸氧腐蚀,其正极的电极反应式是。
|
编号 |
溶液B |
操作及现象 |
|
Ⅲ |
经煮沸的pH=2的 H2SO4 |
溶液表面用煤油覆盖,连接装置后,电压表指针微微偏转,记录读数为b |
|
Ⅳ |
pH=2的H2SO4 |
在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为c;取出电极,向溶液中加入数滴浓Na2SO4溶液混合后,插入电极,保持O2通入,电压表读数仍为c |
|
Ⅴ |
pH=12的NaOH |
在石墨一侧缓慢通入O2并连接装置,电压表指针偏转,记录读数为d |
① 丙同学比较实验Ⅱ、Ⅲ、Ⅳ的电压表读数为:c>a>b,请解释原因是。
②丁同学对Ⅳ、Ⅴ进行比较,其目的是探究对O2氧化性的影响;实验Ⅳ中加入Na2SO4溶液的目的是。
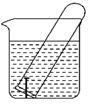
①电极X的材料是;Y溶液可以是;
②银电极上发生的电极反应式是。
③在电池放电过程中,盛有饱和KCl琼脂溶胶的盐桥中,向CuSO4溶液一端扩散的离子是(填离子符号)。
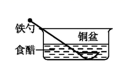
①炒菜的铁锅未及时清洗容易生锈。写出铁锅生锈过程的正极反应式。
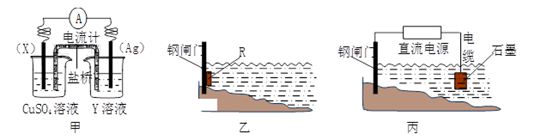
②为了减缓某水库铁闸门被腐蚀的速率,可以采用下图乙所示的方案,其中焊接在铁闸门上的固体材料R可以采用(填写字母序号)。
A.铜 B.钠 C.锌 D.石墨
③图丙所示方案也可以减缓铁闸门的腐蚀速率,则铁闸门应连接直流电源的极。
①若此蓄电池放电时,该电池某一电极发生还原反应的物质是(填序号)。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
②该电池放电时,正极附近溶液的pH(填增大、减小、不变)
③充电时该电池阳极的电极反应式。