 B .
B .  C .
C .  D .
D . 
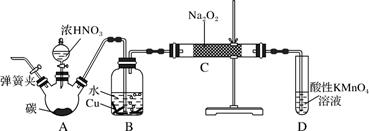
查阅资料:
①HNO2为弱酸,室温下存在反应:3HNO2=HNO3+2NO↑+H2O;
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成;
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸。
实验操作:
①关闭弹簧夹,打开A中分液漏斗活塞,滴加一定量浓硝酸,加热;
②一段时间后停止加热;
③从C中取少量固体,检验是否是亚硝酸钠。
①已知:
CO2(g)+3H2(g)⇌CH3OH(g)+H2O(l) ΔH1
2H2(g)+O2(l)=2H2O(l) ΔH2
CH3OH(g)=CH3OH(l) ΔH3
2CH3OH(l)+3O2(l)=2CO2(g)+4H2O(l) ΔH4
则ΔH4=(用ΔH1、ΔH2、ΔH3来表示)。
②某温度下,发生反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)。在体积为2L的密闭容器中加入1molCH3OH和1molH2O,第4min达到平衡,容器内c(CO2)随时间的变化情况如图1所示,求此反应在该温度下的平衡常数(保留四位有效数字)。保持其他条件不变,在第5min时向体系中再充入0.2molCO2和0.4molH2 , 第8min重新达到平衡,此时c(H2)=c(CH3OH)。请在图1中画出5~9min的c(CO2)变化曲线示意图。


| 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2·H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |
合成过氧化尿素的流程及反应装置图如图:


请回答下列问题:
