 苹果块会干瘪
B .
苹果块会干瘪
B .  胆矾晶体表面有“白斑”
C .
胆矾晶体表面有“白斑”
C .  小试管内有晶体析出
D .
小试管内有晶体析出
D .  pH试纸变红
pH试纸变红
方法一:2NaClO3 + 4HCl → 2ClO2↑+ Cl2↑+ 2NaCl + 2H2O
方法二:H2C2O4 + 2NaClO3 + H2SO4 → Na2SO4 + 2CO2↑ + 2ClO2↑ + 2H2O
完成下列填空:
a.仅做氧化剂 b.既被氧化又被还原
c.发生氧化反应 d.既未被氧化也未被还原
|
氯化物 |
NaCl |
KCl |
CCl4 |
|
熔点/℃ |
804 |
773 |
-22.92 |
试解释表中氯化物熔点差异的原因:。
合成氨工业中:N2(g) + 3H2(g) 2NH3(g) + Q(Q>0),其化学平衡常数K与温度t的关系如表:
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
当测得NH3和N2、H2的物质的量浓度分别为3 mol/L和2 mol/L、1 mol/L时,则该反应υ(N2)(正) υ(N2)(逆)(填写“>”、“=”或“<”)
a.υ(N2)(正)=3υ (H2)(逆) b.混合气体的密度保持不变
c.容器内压强保持不变 d.N2、H2、NH3的浓度之比为1∶3∶2

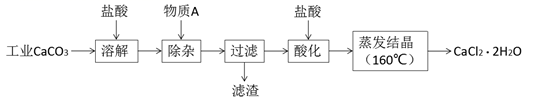
完成下列填空:
|
开始沉淀时的pH |
沉淀完全时的pH |
沉淀开始溶解时的pH |
|
|
Al(OH)3 |
3.3 |
5.2 |
7.8 |
|
Fe(OH)3 |
1.5 |
4.1 |
- |
a.称取0.750 g样品,溶解,在250 mL容量瓶中定容;
b.量取25.00 mL待测溶液于锥形瓶中;
c.用0.050 mol/L AgNO3溶液滴定至终点,消耗AgNO3溶液体积的平均值为20.39 mL。
①上述测定过程中,需要用到的玻璃仪器除了容量瓶、锥形瓶,还有。
②计算上述样品中CaCl2·2H2O的质量分数为(保留三位有效数字)。
③若配制和滴定操作均无误,但最终测定的样品中CaCl2·2H2O的质量分数偏高,写出可能导致该结果的一种情况。