请回答下列问题:
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
工业上用电解法制G的单质的化学方程式是,若以石墨为电极,阳极产生的混合气体的成分是(写化学式).
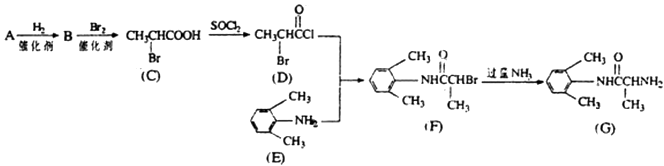
B:,C的名称:.
a.能发生加成反应 b.能使酸性高锰酸钾溶液褪色
c.能与盐酸反应生成盐 d.属于氨基酸
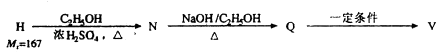
H的结构简式为;N→Q的反应类型为.


① 乙组同学的实验装置中,依次连接的合理顺序为A、B、.装置H反应管中盛有的物质是.
②能证明草酸晶体分解产物中有CO的现象是.
①草酸的酸性比碳酸的强.
②草酸为二元酸.
实验室常用固体草酸钠测定KMnO4溶液的浓度.准确称取0.2000g草酸钠,放入锥形瓶中,加入100mL稀硫酸溶解,用配制好的KMnO4溶液滴定,三次重复实验消耗KMnO4溶液的体积分别是16.02mL、16.00mL、16.01mL,则KMnO4溶液的物质的量浓度的计算式是:c(KMnO4)=.
①在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是.
②吸收液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:
n(SO32﹣):n(HSO3﹣) | 91:9 | 1:l | 9:91 |
pH | 8.2 | 7.2 | 6.2 |
由上表判断,NaHSO3溶液显性(填“酸”、“碱”或“中”),用化学平衡原理解释:.
③当吸收液的pH降至约为6时,需送至电解槽再生.再生示意图如下:
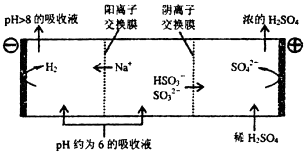
写出HSO3﹣在阳极放电的电极反应式:,当阴极室中溶液pH升至8以上时,吸收液再生并循环利用.
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g);△H=﹣574kJ•mol﹣1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g);△H=﹣1160kJ•mol﹣1
若用标准状况下4.48L CH4还原NO2至N2 , 整个过程中转移的电子总数为(阿伏加德罗常数的值用NA表示),放出的热量为kJ.
一定条件下,将CO(g)与H2O(g)以体积比为1:2置于密闭容器中发生上述反应,达到平衡时测得CO(g)与H2O(g)体积比为1:6,则平衡常数K=.