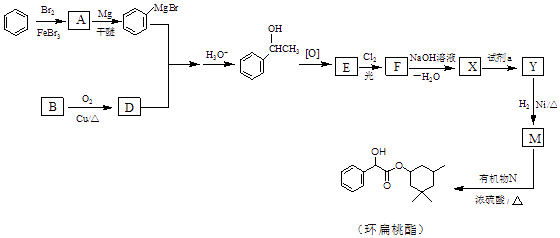
已知: 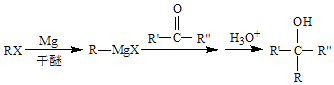 (R、R′、R″代表烃基或氢)
(R、R′、R″代表烃基或氢)
①E的结构简式是.
②E→F的反应类型是.
温度/℃ | 200 | 300 | 400 |
K | 290 | 39 | 11.7 |
①下列分析正确的是.
a.水煤气变换反应的△H<0
b.增大压强,可以提高CO的平衡转化率
c.增大水蒸气浓度,可以同时增大CO的平衡转化率和反应速率
②以氨水为吸收剂脱除CO2 . 当其失去吸收能力时,通过加热使吸收剂再生.用化学方程式表示“吸收”、“再生”两个过程:.
实验Ⅰ | 实验Ⅱ | |
通入气体 | CO、H2 | CO、H2、H2O(g) |
固体产物 | Fe3O4、Fe | Fe3O4 |
结合化学方程式解释H2O(g)的作用:.
①起还原作用的物质是.
②膜Ⅰ侧发生的电极反应式是.
③膜Ⅰ侧所得气体 =3,CH4、H2O、O2反应的化学方程式是.
Cu CuSO4溶液
Cu2(OH)2CO3沉淀
CuO
①过程Ⅰ,H2O2的作用是.
②过程Ⅱ产生Cu2(OH)2CO3的离子方程式是.
③过程Ⅱ,将CuSO4溶液加到Na2CO3溶液中,研究二者不同物质的量之比与产品纯度的关系(用测定铜元素的百分含量来表征产品的纯度),结果如下:
已知:Cu2(OH)2CO3中铜元素的百分含量为57.7%.
二者比值为1:0.8时,产品中可能含有的杂质是,产生该杂质的原因是.
④过程Ⅲ反应的化学方程式是.
【实验1】制备银镜:
ⅱ.向银氨溶液中加入等量的葡萄糖溶液,水浴加热.产生银镜,洗净,备用.
【实验2】溶解银镜:分别向两支试管中加入5mL Fe(NO3)3、Fe2(SO4)3溶液.
编号 | a | b |
试剂 | 0.1mol/L Fe(NO3)3 | 0.05mol/L Fe2(SO4)3 |
现象 | 银镜消失较快; 溶液黄色略变浅; 产生少许白色沉淀 | 银镜消失较慢; 溶液黄色明显变浅; 产生较多白色沉淀 |
ⅰ.测pH:测定实验a中所用Fe(NO3)3溶液的pH=2;
ⅱ.配制溶液:.取5mL此溶液加入有银镜的试管,现象是.
请将步骤ⅱ补充完整.
假设1:Fe(OH)2;假设2:AgNO2;假设3:…
①设计实验方案验证假设1:取少量沉淀置于空气中,未变色.假设1不成立.
②设计实验方案验证假设2(已知:亚硝酸盐能与酸化的KI溶液反应).
实验方案 | 预期现象和结论 |
【实验结论与讨论】铁盐能蚀刻银;NO3﹣能提高铁盐的蚀刻能力.推测硝酸铁溶液如果保持足够的酸性,可以避免产生沉淀.