n(SO32﹣):n(HSO3﹣) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显性,用化学平衡原理解释:.
②当吸收液呈中性时,溶液中离子浓度关系正确的是
a.c(Na+)═2c(SO32﹣)+c(HSO3﹣)
b.c(Na+)>c(HSO3﹣)>c(SO32﹣)>c(H +)═c(OH﹣)
c.c(Na+)+c(H +)═c(SO32﹣)+c(HSO3﹣)+c(OH﹣)

①HSO3﹣在阳极放电的电极反应式是.
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用.简述再生原理:
C(HCl)(CH3COOH)(填<、>或=),若分别用这三种酸中和含等物质的量的NaOH的溶液,所需酸的体积分别为a、b、c,则他们的关系是.
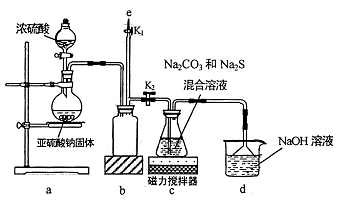
实验中要控制SO2生成速率,可采取的措施有(写出一条)。
已知: a.废水中氰化钠的最高排放标准为0.50mg/L;
b.Ag++2CN-=[Ag(CN)2]- , Ag++I-=AgI↓,AgI 呈黄色,且CN-优先与Ag+反应。
实验如下: 取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。
①滴定时1.00×10-4mol/L的标准AgNO3溶液应用(填仪器名称) 盛装; 滴定终点时的现象是。
②处理后的废水是否达到排放标准(填“是”或“否”)。