a.分离水和CCl4的混合物 b.分离水和酒精的混合物 c.分离水和泥砂的混合物
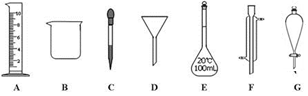
①本实验需取6.0mol/L的盐酸mL,取用该盐酸时,需要用到上述仪器中的A和(选填仪器的编号字母)
②在定容操作时,因不慎加水至凹液面最低处超过了刻度线,该如何处理:
①没有洗涤烧杯和玻璃棒
②转移溶液时不慎有少量洒到容量瓶外面
③容量瓶不干燥,含有少量蒸馏水
④定容时俯视刻度线

|
|
Ⅰ |
Ⅱ |
Ⅲ |
|
a |
干燥的有色布条 |
碱石灰 |
湿润的有色布条 |
|
b |
干燥的有色布条 |
无水氯化钙 |
湿润的有色布条 |
|
c |
湿润的有色布条 |
浓硫酸 |
干燥的有色布条 |
|
d |
湿润的有色布条 |
无水氯化钙 |
干燥的有色布条 |