选择题(本题共13小题,每小题2分,共26分。在每小题给出的四个选项中,只有一个选项符合题目要求)
试题详情
下列热化学方程式中,正确的是( )
- A、 甲烷的燃烧热
, 则甲烷燃烧热的热化学方程式可表示为:
- B、 在
时,
完全燃烧生成液态水,放出
热量,
燃烧的热化学方程式表示为
- C、 HCl和NaOH反应的中和热
, 则
和
反应的中和热
- D、
、
下,已知热化学方程式:
, 将
和
置于密闭容器中充分反应生成
, 放热
试题详情
下列关于化学反应方向的说法正确的是( )
- A、 凡是放热的反应都是自发反应
- B、 凡是需要加热才发生的反应都是非自发反应
- C、 凡是熵增的反应都是自发反应
- D、 反应是否自发,需要综合考虑反应焓变和熵变
试题详情
在反应2HI H2+I2中,有关反应条件改变使反应速率增大的原因分析中,不正确的是 ( )
H2+I2中,有关反应条件改变使反应速率增大的原因分析中,不正确的是 ( )
- A、 加入适宜的催化剂,可降低反应的活化能
- B、 增大
, 单位体积内活化分子数增大
- C、 升高温度,单位时间内有效碰撞次数增加
- D、 增大压强,活化分子的百分数增大
试题详情
在一密闭容器中发生反应:2A(g)+2B(g) C(s)+3D(g)ΔH<0,达到平衡时采取下列措施,可以使正反应速率v正增大、D的物质的量浓度c(D)增大的是 ( )
C(s)+3D(g)ΔH<0,达到平衡时采取下列措施,可以使正反应速率v正增大、D的物质的量浓度c(D)增大的是 ( )
- A、 移走少量C
- B、 选择良好的催化剂
- C、 缩小容积,增大压强
- D、 容积不变,充入1molN2(N2不参加反应)
试题详情
反应4A(s)+3B(g) 2C(g)+D(g),经2 min 后B的浓度减少0.6 mol·L-1。下列说法正确的是 ( )
2C(g)+D(g),经2 min 后B的浓度减少0.6 mol·L-1。下列说法正确的是 ( )
- A、 用A表示的反应速率是0.4 mol·L-1·min-1
- B、 在2 min末的反应速率,用B表示是0.3 mol·L-1·min-1
- C、 分别用B、C、D表示的反应速率,其比值是3∶2∶1
- D、 在这2 min内B和C两物质浓度是逐渐减小的
试题详情
下列有关化学平衡常数的描述中正确的是 ( )
- A、 化学平衡常数的大小取决于化学反应本身,与其他外界条件无关
- B、 相同温度下,反应
与反应
的化学平衡常数相同
- C、 反应
的化学平衡常数随温度升高而增大
- D、 反应
的平衡常数达式为
试题详情
如图是向100 mL pH=1的盐酸中逐渐加入NaOH溶液时,溶液pH的变化图像,根据如图所得结论正确的是( )
- A、 原来盐酸的物质的量浓度为0.1 mol·L-1
- B、 NaOH溶液的物质的量浓度为0.1 mol·L-1
- C、 原来盐酸的物质的量浓度为1 mol·L-1
- D、 NaOH溶液的物质的量浓度为0.01 mol·L-1
试题详情
反应2NO2(g) N2O4(g) △H=-57 kJ/mor, 在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 ( )
N2O4(g) △H=-57 kJ/mor, 在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是 ( )

- A、 T1>T2
- B、 X、Y两点的反应速率:X>Y
- C、 X、Z两点气体的颜色:X深,Z浅
- D、 X、Z两点气体的平均相对分子质量:X>Z
试题详情
如图所示是298K时,A2与B2反应过程中能量变化的曲线图,下列叙述正确的是 ( )

- A、 每生成2 molAB吸收b kJ热量
- B、 加入催化剂,反应的活化能和反应热都改变
- C、 该反应的热化学方程式为A2(g)+B2(g)=2AB(g) △H= + (a-b) kJ/mol
- D、 断裂1 mol A-A和1 mol B-B键,放出a kJ能量
试题详情
一定温度下,将2 mol A和2 mol B两种气体混合放入体积为2 L的密闭刚性容器中,发生反应3A(g)+B(g) = xC(g)+2D(g),2 min 末反应达到平衡,生成0.8 mol D,并测得C的物质的量浓度为0.4 mol/L,下列说法正确的是 ( )
- A、 此温度下该反应的平衡常数K等于0.5
- B、 A的平衡转化率为40%
- C、 x的值为1
- D、 A和B的平衡转化率相等
试题详情
下列反应中,反应速率最大的是( )
- A、 25 ℃时,镁条与0.1 mol·L-1盐酸反应
- B、 25 ℃时,镁条与0.2 mol·L-1盐酸反应
- C、 35 ℃时,镁条与0.2 mol·L-1盐酸反应
- D、 35 ℃时,镁条与0.3 mol·L-1盐酸反应
选择题(本题共5小题,每小题3分,共15分。每小题有一个或两个选项符合题目要求,全部选对得3分,选对但不全的得1分,有选错的得0分)
试题详情
下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是 ( )
选项 | A | B | C | D |
强电解质 | HNO3 | NaCl | BaSO4 | 盐酸 |
弱电解质 | CH3COOH | NH3 | H3PO4 | Fe(OH)3 |
非电解质 | C6H12O6(葡萄糖) | CO2 | C2H5OH | H2O |
试题详情
常温下1mol化学键分解成气态原子所需要的能量用E表示,结合表中信息下列说法不正确的是( )
共价键 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ/mol) | 436 | 157 | 568 | 432 | 298 |
试题详情
在不同温度下的水溶液中离子浓度曲线如图所示,下列说法不正确的是 ( )

- A、 向b点对应的醋酸溶液中滴加NaOH溶液至a点,此时c(Na+)=c(CH3COO-)
- B、 25 ℃时,加入CH3COONa可能引起由b向a的变化,升温可能引起由a向c的变化
- C、 T℃时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液呈中性
- D、 b点对应的溶液中大量存在:K+、Ba2+、NO3-、I-
试题详情
将V1mL 1.0mol/L HCl溶液和V2mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如下图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )
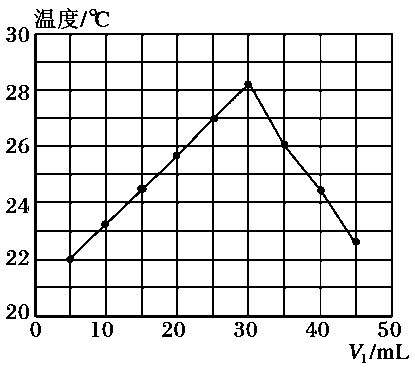
- A、 做该实验时环境温度为22℃
- B、 该实验表明有水生成的反应都是放热反应
- C、 NaOH溶液的浓度约为1.0mol/L
- D、 该实验表明化学能可能转化为热能
非选择题(本题共4小题,共59分)
试题详情
Ⅰ.以下是关于合成氨的有关问题,请回答:
试题详情
已知在25℃时,醋酸、碳酸和亚硫酸的电离平衡常数如下表所示:
酸 | 电离平衡常数 |
醋酸 | |
碳酸 |
|
亚硫酸 |
|
试题详情
某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL容量瓶中配制250 mL烧碱溶液
B.用移液管(或碱式滴定管)量取25.00 mL烧碱溶液于锥形瓶中并加几滴甲基橙指示剂
C.在天平上准确称取烧碱样品w g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为m mol/L的标准H2SO4溶液装入酸式滴定管,调整液面,记下开始刻度V1 mL
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点刻度为V2 mL
请完成下列问题: