选择题
- A、 同种电荷相互排斥
- B、 电荷的定向移动形成电流
- C、 力是改变物体运动状态的原因
- D、 一个α粒子的质量比一个电子的质量大得多
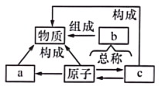
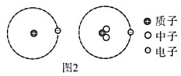
- A、 图中a为分子,b为元素,c为离子
- B、 由图可知,分子、原子、离子都是构成物质的微粒
- C、 原子得到电子可形成阴离子,原子失去电子可形成阳离子
- D、 不同种元素的两种离子,质子数一定不相同,电子数也一定不相同
- A、 碳原子核,含7个质子、8个中子
- B、 氮原子核,含7个质子、7个中子
- C、 碳原子核,含6个质子、7个中子
- D、 氧原子核,含7个质子、8个中子
- A、 16
- B、 32
- C、 32克
- D、 33
①核电荷数相同 ②核外电子数相等
③电子层结构相同 ④质量几乎相等
⑤所含的质子数相等
- A、 ①③④⑤
- B、 ②③④
- C、 ①④⑤
- D、 ③④⑤
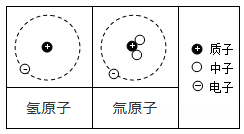
- A、 氚原子与氢原子的核外电子数相同
- B、 氚原子与氢原子的核电荷数不同
- C、 氚与氢元素不属于同种元素
- D、 氚原子与氢原子相对原子质量相同
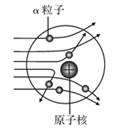
- A、 绝少数a粒子向两侧偏转,说明原子中心的“核”带正电
- B、 绝少数a粒子偏转的角度很大,说明原子“核”外有带负电的电子
- C、 绝大多数a粒子仍沿原来方向穿过,说明原子中绝大部分是“空”的
- D、 绝少数a粒子被反弹回来,说明原子中心有一个体积小而质量大的“核”
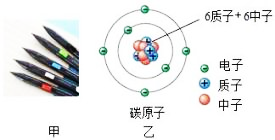
- A、 所有原子中,质子数=中子数=核外电子数
- B、 中子的质量相对于带电的质子和电子,可以忽略
- C、 质子和中子由更小的、不能再分的夸克构成
- D、 该碳原子还存在同位素原子14C,即质子数为6,中子数为8
填空题

族周期 | IA | 0 | ||||||
1 | ⅡA | ⅢA | IVA | VA | VIA | VⅡA | He | |
2 | Li | Be | B | C | N | O | F | Ne |
3 | Na | Mg | Al | Si | P | S | Cl | Ar |
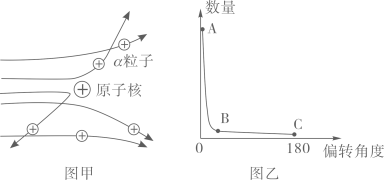
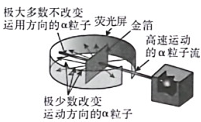
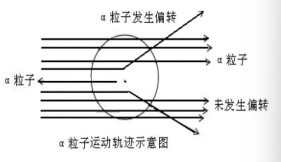
现象1:大多数α粒子能穿透金箔而不改变原来运动方向;现象2:少部分α粒子改变原来的运动方向;
现象3:极少数α粒子被弹了回来。

[收集证据]绝大多数α粒子穿过金箔后仍沿原来的方向前进,只有少数α粒子发生了较大的偏转,并且有极少数α粒子的偏转超过90°,有的甚至几乎达到180°,像是被金箔弹了回来。
[猜想与假设] α粒子遇到电子后,就像飞行的子弹碰到灰尘一样运动方向不会发生明显的改变,除非原子的大部分质量集中到了一个很小的结构上,否则大角度的散射是不可能的。
[解释与结论]
实验探究题
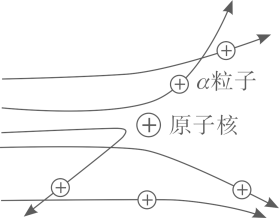
现象 1:大多数α粒子能穿透金箔而不改变原来的运动方向。
现象 2:一小部分α粒子改变原来的运动方向。
现象 3:极少数α粒子被弹了回来。
请回答下列问题:
解答题
| 时间 | 人物 | 对“原子—分子”的认识 |
| 1803年 | 道尔顿 | 元素由微小的不可分的原子组成;不同元素的原子以简单数目比形成不可再分的原子——“复杂原子”。 |
| 1809年 | 盖·吕萨克 | 在同温同压下,相同体积的不同气体中含有相同数目的原子(包括“复杂原子”)。 |
| 1811年 | 阿伏加德罗 | 提出分子学说。引入分子概念,指出分子与原子的区别和联系。随后科学家们确立并逐步完善了“原子—分子”学说。 |
| 1897年 | 汤姆生 | 提出电子嵌于原子表面的枣糕型原子结构,否定了“原子不可再分“的观点。 |
| 1903年 | 卢瑟福 | 用a粒子轰击金箔的实验,推翻了汤姆生提出的原子结构模型,为建立现代原子理论打下了基础。 |



